
http://dx.doi.org/10.15649/2346030X.718
Determinación de la viabilidad de semillas de capsicum annuum L usando la prueba de tetrazolio.
Determining the viability of capsicum annuum L seeds using the tetrazolium test.
Seir Antonio Salazar-Mercado1
Jesús David Quintero-Caleño2
Jhan Piero Rojas-Suárez3
1Universidad Francisco de Paula Santander, Colombia. E-mail: salazar663@hotmail.com Autor de correspondencia
2Universidad Francisco de Paula Santander, Colombia.
3Universidad Francisco de Paula Santander, Colombia.
Recibido: 14 de Mayo de 2020.
Aceptado: 19 de Agosto de 2020.
Resumen— El pimentón (Capsicum annuum L) es uno de los cultivos de hortalizas más importantes y ampliamente cultivados a nivel mundial. Este estudio determinó la eficacia del test tetrazolio para obtener la viabilidad de semillas de C. annuum. De manera que, semillas de C. annuum se expusieron a dos concentraciones (1% y 0.5%) de tetrazolio y dos tiempos de exposición (24 y 48horas). La prueba de tetrazolio se fundamenta en la coloración del embrión y tejidos vivos de la semilla, gracias a la oxidación de la sal de tetrazolio por la respiración celular. Ulteriormente, utilizando un microscopio estereoscopio se valoró la tinción de las semillas, estimando como semillas viables las que presentaron coloración roja en el embrión. Por consiguiente, se obtuvieron diferencias estadísticamente significativas (P≤ 0,05) en el tratamiento T4 (0.5 %, 48h) con un 99% de viabilidad. Así mismo, los tratamientos T1 (1 %, 24h) y T2 (0.5 %, 24h) no presentaron diferencias entre sí, siendo el porcentaje de viabilidad 89% y 91% respectivamente. Para la prueba de germinación real, se obtuvo un 84.4% (promedio) de germinación para las 5 repeticiones. Se concluye que mediante el ensayo de tetrazolio la valoración de la viabilidad en semillas de pimentón es eficiente para las concentraciones de 1% y 0.5 %, durante 24 horas.
Palabras clave: Cloruro de trifeniltetrazolio, Germinación, Pimentón, Semilla, Vigor.
Abstract - Paprika (Capsicum annuum L) is one of the most important and widely cultivated vegetable crops worldwide. This study determined the efficacy of the tetrazolium test to obtain the viability of C. annuum seeds. So, C. annuum seeds were exposed to two concentrations (1% and 0.5%) of tetrazolium and two exposure times (24 and 48 hours). The tetrazolium test is based on the coloration of the embryo and living tissues of the seed, thanks to the oxidation of the tetrazolium salt by cellular respiration. Subsequently, using a stereoscope microscope, the staining of the seeds was assessed, estimating as viable seeds those that presented red coloration in the embryo. Therefore, statistically significant differences (P≤ 0.05) were obtained in the T4 treatment (0.5%, 48h) with 99% viability. Likewise, the treatments T1 (1%, 24h) and T2 (0.5%, 24h) did not show differences between them, the viability percentage being 89% and 91% respectively. For the real germination test, 84.4% (average) of germination was obtained for the 5 repetitions. It is concluded that through the tetrazolium test the assessment of the viability in paprika seeds is efficient for concentrations of 1% and 0.5%, for 24 hours.
Key words: Triphenyltetrazolium Chloride, Germination, Paprika, Seed, Vigor.
El pimentón (Capsicum annuum L) es una de las plantas más cultivadas del reino Plantae [1]. China, México y Turquía son los principales productores a nivel mundial [2]. Se originó en América del Sur [3], hace parte de la familia solanáceae [4] y al género Capsicum, el cual tiene gran importancia en la horticultura, la agricultura y en la industria farmacéutica y medicinal [5]. C. annuum, se caracterizan por la presencia de frutos desarrollados, formatos cuadrados, cónicos o alargados, y se consumen en estado verde o maduro en forma de ensalada o cocidos [6]. Colombia, logró en 2013 producir 42.236 toneladas, Antioquia es el departamento con mayor producción (12.396 toneladas), lo siguen Norte de Santander, Valle del Cauca y Santander [7].
El pimentón posee una gran diversidad genética y fenotípica [8], como es el caso de Capsicum annuum var. Aviculare (Dierb.) D'Arcy & Eschbaugh. El cual, esta protegido en solares de forma semisilvestre [9]. Debido al legado genético e histórico, el pimentón ha sido parte de la dieta humana durante al menos un siglo [10]. Cuenta con un gran potencial como fuente de metabolitos secundarios utilizados en productos farmacéuticos, agroquímicos, fragancias, colorantes, bioinsecticidas, y aditivos [11, 12, 13].
La germinación de las semillas de C. annuum puede variar y a menudo es lenta y no uniforme en condiciones de estrés abióticos, tales como alta salinidad, toxicidad por agroquímicos o bajas temperaturas [14, 15, 16, 17, 12]. De igual manera, aspectos genéticos, condición del suelo y el estado físico de las semillas influencian la geminación [18]. En consecuencia, conocer las condiciones fisiológicas de la semilla resulta muy importante. Por consiguiente, evaluar el potencial fisiológico y el vigor de la semilla, tiene muchas implicaciones para la agricultura. Siendo una herramienta valiosa para seleccionar semillas de óptima calidad, buscando satisfacer las demandas del agricultor [19].
La prueba de tetrazolio, ha sido exitosa para conocer el potencial germinativo en una gran variedad de especies vegetales [20, 21, 22, 23, 19, 24] y como método para validar la calidad de las semillas [25]. Dicha prueba se ha mostrado como una alternativa importante por la exactitud y rapidez en la estimación del vigor y la viabilidad, lo que permite obtener resultados en poco tiempo [26, 27]. El test de tetrazolio se fundamenta en la reducción de la sal de tetrazolio dentro del tegido vivo de la semilla, gracias a la actividad de la enzima deshidrogenasa del ácido málico [28]. La solución se disemina a través de la semilla, lo que causa una reducción de la sal formando un compuesto rojo insoluble llamado Formazan, lo que indica respiración mitocondrial, por tanto, la viabilidad de la semilla [29, 30]. Los tejidos no viables conservan su color natural, ya que no reaccionan con la solución [19]. Por otro lado, es necesario confirmar la veracidad de la prueba del tetrazolio mediante la germinación (fisiológica), permitiendo estimar la capacidad germinativa y distinguir el exito de las semillas para ser siembradas en campo [30]. En consecuencia, y dado a los pocos estudios sobre la viabilidad de semillas de C. annuum. La presente investigación estudia la incidencia de dos concentraciones y dos tiempos de exposición en la eficiencia de la prueba de tetrazolio, para evaluar la viabilidad en semillas de C. annuum. Además de comparar con la prueba de germinación
a) Material vegetal
b)Test de Tetrazolio
Se observó y cuantificó la tinción, para determinar la viabilidad, se colocaron semillas sanas dentro de placas de Petri (5mm x 10mm), luego de aplicar la solución de tetrazolio al 0,5% y 1% (5ml), se mantuvieron en condiciones de total penumbra por 24 y 48 horas a 25°C (Tabla 1). Al terminar el tiempo de exposición, con la ayuda de un colador se separaron las semillas. Para ser exa¬minadas en el microscopio estereoscopio (Leica EZ4). Las semillas con embriones con coloración roja intensa causada por la reducción del tetrazolio a formazan por la respiración celular [34, 35], se tomaron como semillas viables. De igual forma, los embriones con colores rosas pálidos y/o con falta de coloración, se tomaron como con viabilidad baja o muertos.
c) Germinación Fisiológica
Se utilizó el método de germinación descrito por la ISTA [36]. En toallas de papel húmedas en condiciones de oscuridad la temperatura alternó entre los 20 y 30 °C, donde la alta pertenece al horario diurno (8 h) y la baja al ciclo nocturno (16 h). La humedad relativa se mantuvo en 80% [37]. Se utilizaron recipientes de plástico transparente anteriormente desinfectados. Se aplicó agua a razón de 35 ml por gramo de papel [38]. Se evaluaron 100 semillas con 5 repeticiones, Estas se sometieron a oscuridad y reposo durante 72 horas. Seguidamente, se contaron las semillas germinadas, lo que evidencia directamente el porcentaje de germinación. A continuación, lo obtenido en el test de viabilidad y el porcentaje de germinación se compararon.
Tabla 1: Concentraciones y tiempos de exposición de Tetrazolio utilizados en C. annuum.
Tratamientos |
Concentraciones de Tetrazolio |
Tiempo de exposición (horas) |
T1 |
1 % |
24 |
T2 |
0,5 % |
24 |
T3 |
1 % |
48 |
T4 |
0,5 % |
48 |
d) Diseño experimental
El estudio se basó en un diseño completamente aleatorio, con 100 semillas por repetición y 5 repeticiones, para cada experimento (Prueba de germinación fisiológica y prueba de tetrazolio). Los datos se procesaron gracias al análisis de varianza ANOVA. Seguidamente, utilizando la prueba de rangos múltiples Honesta Diferencia Significativa de Tukey [39], se compararon las medias obtenidas, para determinar las diferencias significativas a un nivel de P≤ 0.05. El estudio estadístico se realizo con el software Infostat y con el software KyploT 2.0 se efectuaron las gráficas.
a) Prueba de viabilidad
Se observó variación entre los tratamientos, de acuerdo con el análisis de la coloración en las semillas de C. annuum L. Se estableció la viabilidad según la coloración de los embriones [19, 22, 30]. Es así, que los totalmente teñidos de rojo intenso, se determinaron como vivos con alto vigor (Figura 1, A y D), Así también, si su tinción era rojo pálido o con partes descoloridas, se cuantificaron como vivos con bajo vigor (Figura 1, B, C y D) y cuando permanecieron incoloros, como no viables, (Figura 1, E). Por lo tanto, la viabilidad es el porcentaje de semillas con coloración en la zona de embrión (Figura 1). En consecuencia, se observaron diferencias significativas en T4 (0.5%, 48h) provocando un mayor porcentaje de tinción de 99% (Tabla 2). Igualmente, no se hallaron diferencias estadísticamente significativas entre T1 (1 %, 24h) y T2 (0.5 %, 24h), ambos con medias inferiores al resto de los tratamientos, siendo el porcentaje de viabilidad 89% y 91% respectivamente. Teniendo similitud con lo obtenido por Rodríguez et al. [40], en semillas de Ugni molinae donde la prueba de tetrazolio (1%, 24h, 30°C) arrojó una viabilidad de 87 % en semillas desinfectadas y 91 % en las semillas sin desinfectar. Cabe resaltar, que T2 (0.5 %, 24h) y T3 (1 %, 48h), no mostraron diferencias significativas entre sí, siendo tan solo de 3% la diferencia entre las semillas viables y no viables (Tabla 2). Por consiguiente, el tratamiento T4 fue el más eficiente respecto a la tinción de células metabólicamente activas, ya que la viabilidad casi llegó al 100% (Tabla 2) y además disminuye a la mitad la concentración de tetrazolio en comparación con el tratamiento T3, el cual, presentó un porcentaje considerable de viabilidad (94%). Estos resultados difirieren de los encontrados por da Silva et al. [41], en donde se constató que la viabilidad obtenida en la prueba de tetrazolio, conducida con semillas enteras de Araucaria angustifolia en las condiciones recomendadas por las reglas para el análisis de semillas (1%, 24 h, 30°C), fue considerablemente inferior a la observada en la prueba de germinación [42].
Tabla 2: Viabilidad de semillas de C. annuum utilizando la prueba de Tetrazolio.
|
Viabilidad de C. annuum |
|
Tratamientos |
Semillas Viables |
Semillas No viables |
T1 (1 %, 24h) |
89±3.6a |
11±1.6a |
T2 (0.5 %, 24h) |
91±2.7ª |
9±1.1a |
T3 (1 %, 48h) |
94±5.4a,b |
6±1.8a,b |
T4 (0.5 %, 48h) |
99±1.5b |
1±0.3b |
Los valores ± SD con diferente letra, indican diferencias estadísticamente significativas, según la prueba de Tukey (P≤0.05). SD: Desviación estándar |
||
Fuente: Elaboración propia.
En una investigación realizada en Hordeum vulgare por Grzybowski et al. [43], se observó que la prueba de viabilidad con tetrazolio, para las concentraciones de 0.1% y 0.5% (2h; 20oC) fueron similares (95% y 95% respectivamente) a las obtenidas en este estudio (Cuadro 2). Por tanto, se sugiere la posibilidad de utilizar la solución de cloruro de tetrazolio en concentraciones más bajas (0.1% o 0.2%), que además de ser más económica, permite la adecuada tinción de los tejidos en la semilla, sin desfavorecer la distinción de la viabilidad. Esta reducción en la concentración de la solución de sal de tetrazolio, utilizada en el procedimiento de tinción también; se sugirió para otras semillas de cultivos tales como: 0.050%, 6 h, 35ºC o por 4 h, 40ºC en semillas de pepino [23]; 0,5% para semillas de Ochroma pyramidale [44]; 0.2% para las semillas de ricino [45].

Figura 1: Coloración de las semillas de C. annuum utilizando el test de tetrazolio. (A, B, C, D) Semillas viables. (E) Semillas no viables. (F) Semilla control.
Fuente: Elaboración propia.
La germinación es uno de los eventos más importantes del desarrollo de una planta, ya que se pasa de ser un organismo inactivo a activo, de ser heterótrofos a autótrofos, de estar protegidos a exponerse a factores abióticos [46]. La prueba de germinación fisiológica sirve para reconocer las semillas no germinadas por tener embrión dañado, haber sido abortadas, o latentes [47]. Debido a que, aún en condiciones óptimas de temperatura y humedad, a causa de la dormancia, la cual es una propiedad adaptativa de las semillas [48], una semilla viable no llega a germinar, [49] Es por esto, que se recomienda utilizar más de un método para corroborar la información sobre su capacidad de germinación [50]. La germinación real se efectuo para comparar los resultados de ambos ensayos (Test de tetrazolio y germinación fisiológica), a fin de exclarecer la fiabilidad de la prueba de tetrazolio [51]. En la primera se obtuvó un promedio de 84.4% de germinación para las 5 repeticiones (Tabla 3), más bajo en comparación a la viabilidad de T1 (1 %, 24h) (Figura 2), con diferencias significativas con T2, T3 y T4 (Figura 2). Constatando lo descrito por Andrade y Laurentín [52], donde semillas de Capsicum chinense Jacq, no germinaron aun teniendo condiciones aparentemente favorables, siendo un inconveniente, en el ámbito agronómico, viendo esta tendencia en resultados similares como en semillas de Taxodium mucronatum (Ten.), donde la germinación fue del 20% en condiciones de oscuridad, y la viabilidad evaluada por método de tetrazolio fue del 57.3% (0.5%, 24h, cajas Petri) [53]. Para Hernández et al. [54], las variaciones de factores externos como la temperatura afectan la germinación de Capsicum annuum var. Glabriusculum, del mismo modo, los cambios en el ambiente de la planta (parental) durante el desarrollo de las semillas. Sin embargo, el test de tetrazolio, proporcionó información sobre si las semillas analizadas tenían potencial germinativo, independientemente de la concentración usada, afirmando que el 93.25% de las semillas tenían la posibilidad de germinar.
Tabla 3. Promedio de Germinación fisiologica de C. annuum
Repeticiones |
Porcentaje de Germinación |
1 |
80 |
2 |
87 |
3 |
87 |
4 |
90 |
5 |
80 |
Media |
84,4 |
Fuente: Elaboración propia.
Al comparar el promedio de germinación y la viabilidad de los diferentes tratamientos, se puede observar que los diferentes grados de coloración (Figura 1. A, B, C y D), indican que las que presentaron patrones de tinción intermedios, también poseen la capacidad de originar plántulas normales, es decir, son viables. Por tanto, la presencia de células vivas del embrión es indicada por una coloración rojo intenso, por lo que un color rojo pálido indica baja viabilidad y la nula coloración (color natural) demarca un embrión muerto [55]. Dichos resultados pueden compararse con los obtenidos por Victoria et al. [56], donde se utilizó tetrazolio al 0.5 % en Calendula officinalis por tiempos y temperaturas diferentes, obteniendo la coloración de los cotiledones solamente. De igual forma, las semillas de Anethum graveolens, presentaron tinciones con tetrazolio al 1 % en el embrión y con 0.5% de la semilla completa. La proporción de la zona teñida se utiliza para dimensionar el vigor de la semilla [57], donde según el ISTA [58], un lote de semillas vigoroso es uno que potencialmente puede funcionar bien en condiciones ambientales, que no son óptimas para la especie. La información de la germinación y viabilidad del género Capsicum es escasa, ya que sólo en algunas especies se ha documentado, siendo imposible generalizarse. Martínez et al. [59], encontraron resultados parecidos en Capsicum annuum L. var. Unapal-Serrano, donde hubo un 92% de viabilidad y 86% germinación, así mismo Mathad et al. [60], encontró un 89% de viabilidad para semillas de Capsicum annuum L con el método de tetrazolio, lo que verifica la importancia de la aplicación de esta prueba para determinar la viabilidad de semillas de una gran variedad de especies. Al equiparar el test de tetrazolio y la germinación real se pueden observar diferencias, ya que la prueba de tetrazolio no permite discriminar infecciones causadas por hongos, alguna anormalidad del tejido expuesto o alguna posible fitotoxicidad, ya que, es una reacción bioquímica que resalta el tejido vivo de entre el tejido muerto en el embrión de la semilla, gracias a la actividad de las enzimas deshidrogenasas [61].
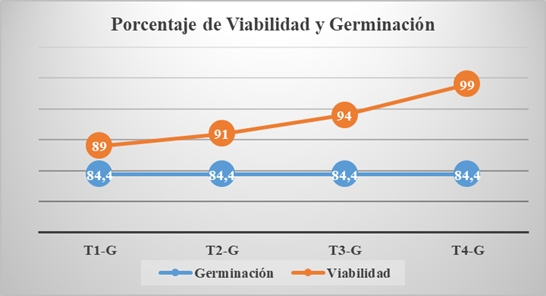
Figura 2: Comparación de la germinación fisiológica frentre a los tratamientos de viabilidad y de Capsicum annuum. (T1-G) Comparación T1 y germinación real. (T2-G) Comparación T2 y germinación real. (T3-G) Comparación T3 y germinación real. (T4-G) Comparación T4 y germinación real.
Fuente: Elaboración propia.
Se recomienda la reducir de la concentración de tetrazolio, como alternativa para disminuir el costo de la prueba en el genero Capsicum. Del mismo modo, se propone la utilización de pretratamientos en las semillas de C. annuum, según lo propuesto por Salazar et al. [62], donde el uso de Sacarosa y Cloro al 10%, aumento la eficiencia de la prueba de tetrazolio.
Se determinó la alta eficiencia de la prueba de tetrazolio para evaluar la viabilidad de las semillas de pimentón, cuando se realiza a una concentración de 1% y 0.5 %, durante 24 horas, con respecto a la germinación real. Además, se determinó que la germinación en toalla de papel húmeda, es una buena alternativa para obtener el porcentaje de germinación en un tiempo de 72 horas. Se expone la necesidad de realizar estudios adicionales donde se implementen concentraciones menores a 0.5 % (0.2%, 0.1%), para determinar la eficiencia del test de tetrazolio en C. annuum.
[1]Cheng, G., Li, R., Jun, M., Muhammad, A., y Hui, A. Variation in leaf color and combine effect of pigments on physiology and resistance to whitefly of pepper (Capsicum annuum L.). Sci Hort, 229(1), 215-225. 2018.
[2]Mejía Teniente, L., Duran Flores, F. de D., Torres Pacheco, I., Cruz Hernandez, A., Gonzalez Chavira, M., Ocampo Velazquez, R. V., y Guevara Gonzalez, R. Oxidative and molecular responses in Capsicum annuum L. after hydrogen peroxide, salicylic acid and chitosan foliar applications. Int. J. Mol. Sci, 14(5), 10178-10196. 2013.
[3]Kim, S., Park, M., Yeom, S. et al. Genome sequence of the hot pepper provides insights into the evolution of pungency in Capsicum species. Nat. Genet, 46(3), 270-278. 2014.
[4]Arrowsmith, S., Egan, P., Forrest, J., et al. Effects of salt stress on capsaicin content, growth, and fluorescence in a Jalapeño cultivar of Capsicum annuum (Solanaceae). BIOS, 83(1), 1-7. 2012.
[5]Rodríguez Calzada, T., Qian, M., Strid, Å., Neugart, S., Schreiner, M., Torres Pacheco, I., y Guevara González, R. Effect of UV-B radiation on morphology, phenolic compound production, gene expression, and subsequent drought stress responses in chili pepper (Capsicum annuum L.). Plant Physiology and Biochemistry, 134(1), 94-102. 2019. Doi: 10.1016/j.plaphy.2018.06.025
[6]Vallejo, C., Franco, A., y Salazar, E. Producción de hortalizas de clima cálido. Universidad Nacional de Colombia, Cali. 2004. ISBN 958809528.
[7]DANE. El cultivo del pimentón (Capsicum annuum L) bajo invernadero. Boletín mensual insumos y factores asociados a la producción agropecuaria, 37(1), 1-74. 2015.
[8]Rivera, A., Monteagudo, A., Igartuac, E., Taboada A. et al. Assessing genetic and phenotypic diversity in pepper (Capsicum annuum L.) landraces from North-West Spain. Sci. Hort, 203(1), 1-11. 2016.
[9]Latournerie, M., Chávez, L., Pérez, M., Castañón A. et al. Valoración in situ de la diversidad morfológica de chiles (Capsicum annuum L. y Capsicum chinense Jacq.) en Yaxcabá, Yucatán. Rev. Fitotec. Mex, 25(1), 25-33. 2002.
[10]Vela, E. El chile: una breve historia. Arqueologia Mexicana, 32(especial), 7-27. 2009.
[11]Murthy, H., Lee, E., y Paek. K. Production of secondary metabolites from cell and organ culture: strategies and approaches for biomass improvement and metabolite accumulation. Plant Cell Tissue Organ Cult, 118(1), 1-16. 2014.
[12]Barchenger, D., y Bosland, P. Exogenous applications of capsaicin inhibits seed germination of Capsicum annuum. Sci Hort, 203(1), 29-31. 2016.
[13]Korkmaz, A., Adnan, A., y Ferit. A. Evaluation of the volatile compounds of fresh ripened Capsicum annuum and its spice pepper (dried red pepper flakes and isot). LWT. Food Sci. Technol, 84(1), 842-850. 2017.
[14]Demir, I., y Mavi, K. Effect of salt and osmotic stresses on the germination of pepper seeds of different maturation stages. Braz Arch Biol Techno, 51(5), 897-902. 2008. Doi: 10.1590/S1516-89132008000500004.
[15]Salazar, S., y Quintero, J. Cytotoxic evaluation of glyphosate, using Allium cepa L. as bioindicator. Science of The Total Environment, 700, 134452. 2020. Doi: 10.1016/j.scitotenv.2019.134452
[16]Salazar Mercado, S., Torres León, C., RojasSuárez, J. Cytotoxic evaluation of sodium hypochlorite, using Pisum sativum L as effective bioindicator. Ecotoxicology and Environmental Safety, 173, 71-76. 2019. doi.org/10.1016/j.ecoenv.2019.02.027.
[17]Salazar Mercado, S., y Maldonado Bayona, H. Evaluation of cytotoxic potential of chlorpyrifos using Lens culinaris Med as efficient bioindicator, Ecotoxicology and Environmental Safety, 183, 109528. 2019. doi.org/10.1016/j.ecoenv.2019.109528.
[18]Bewley, J., y Black, M. Physiology and Biochemistry of Seeds in Relation to Germination. Viability, Dormancy, and Environmental Control, vol. 2. Springer Science Bussiness Media, Berlin, Germany. 2012.
[19]Salazar, S., y Botello, E. Viabilidad de semillas de Glycine max (I.) Utilizando la prueba de tetrazolio. Revista de Investigación Agraria y Ambiental, 9(2). 2018. Doi: 10.22490/21456453.227
[20]Salazar, S., Zulay A., y Barrientos, F. Evaluation of different in vitro culture media in the development of Phalaenopsis hybrid (Orchidaceae). Rev colomb. Biotecnol, 15(2), 97-105. 2013.
[21]Salazar, S. A., Quintero, J. & Bustos, V. Implementación de la prueba de tetrazolio en las semillas de Raphanus sativus L. Revista Facultad De Ciencias Básicas, 15(2), 7-15. 2020. https://doi.org/10.18359/rfcb.3831
[22]Mercado, S., Caleño, J., y Rozo, L. Improvement of the methodology of the tetrazolium test using different pretreatments in seeds of the genus Epidendrum (Orchidaceae). Journal of Seed Science, 42, e202042013. 2020. Doi: 10.1590/2317-1545v42231028
[23]Salazar, S., Quintero, J., Rojas, J. Cytogenotoxic effect of propanil using the Lens culinaris Med and Allium cepa L test. Chemosphere, 249, 126193. 2020. Doi: 10.1016/j.chemosphere.2020.126193
[24]Salazar, S., Botello, H., y Quintero, J. Efecto de pretatamientos en la prueba de tetrazolio en semillas de Epidendrum barbaricum Hágsater & Dodson. Acta Agronómica, 68(4), 306-311. 2019. Doi: 10.15446/acag.v68n4.79619.
[25]Costa, N., França, J., Krzyzanowski, F., Henning, A. y Pereira, J. Avaliação de metodologia alternativa para o teste de tetrazólio para sementes de soja. Scientia Agricola, 55(2), 305-312. 1998. Doi: 10.1590/S0103-90161998000200021
[26]Días, M., y Alves, S. Avaliação da viabilidade de sementes de Panicum maximum Jacq pelo teste de tetrazolio. Revista Brasileira de Sementes, 30(3): 152-158. 2008.
[27]Fogaça, C., Malavasi M., y Zucareli, C. Aplicação do teste de tetrazólio em sementes de Gleditschia amorphoides Taub. Caesalpinaceae. Rev. bras. Sementes, 28(3), 101-107. 2006.
[28]Canuto, R. Dehydrogenases. InTech Design Team, Croatia, 366 p. 2012.
[29]Salazar Mercado, S., y Vega Contreras, N. Asymbiotic seed germination and in vitro propagation of Cattleya trianae Linden & Reichb.f. (Orchidaceae). Acta Agronómica, 66(4), 544-548. 2017. Doi: 10.15446/acag.v66n4.63597.
[30]Salazar, S., Maldonado, H., Quintero, J. Evaluación de la calidad fisiológica de las semillas de Linum usitatissimum L. con la prueba de tetrazolio. Avances en Investigación Agropecuaria, 22(3), 25-35. (2018).
[31]Instituto de Hidrología, Meteorología y Estudios Ambientales - IDEAM. Grupo de Climatología y Agrometeorología Subdirección de Meteorología - Cartográfia Básica IGAC, Atlas Climatológico de Colombia, Bogotá, Colombia. 2018.
[32]Nogueira, A., y Medeiros, A. Coleta de Sementes florestais nativas. Circular Técnica, número 144. 2007.
[33]Ossenbach, C., Arce, J., y Warner, J. Almacenamiento de semi-llas de diferentes especies de orquídeas para su conservación en un banco de germoplasma: Deshidratación, almacena¬miento y pruebas de viabilidad de las semillas. Tierra Tropical, 3(1), 47-59. 2007.
[34]Salazar, S. Germinación asimbiótica de semillas y desarrollo in vitro de plántulas de Cattleya mendelii Dombrain (Orchidaceae). Acta Agronómica, 61(1), 69-78. 2012.
[35]Salazar, S., Botello, H., y Quintero, J. (2020). Optimización de la prueba de tetrazolio para evaluar la viabilidad en semillas de Solanum lycopersicum L. Ciencia & Tecnología Agropecuaria, 21(3).
[36]International Seed Testing Association. International Rules for Seed Testing. Seed science and Technology 31. Supplement. Zürich. 2012.
[37]Pollock, B. M., y Ross, E. E. Seed and seedling vigour. In Seed biology T. T. Kozlowski (ed.) vol. 1. Academic Press. Nueva York. p 387. 1972.
[38]Patil, N., Datir, S., y Shah, P. Salt-Induced Physiological and Biochemical Changes in two varieties of Linum usitatissimum L. Int. J. Curr. Microbiol. App. Sci, 4(9), 296-304. 2015.
[39]Tukey, J. The problem of multiple comparisons. En: H. L. Braun (ed.). The collected works of John W. Tukey. Nueva York. Chapman and Hall, 8, 300. 1994.
[40]Rodríguez, M., Chacon, M., y Carrillo, R. Efecto de la concentración y de los componentes del medio de cultivo MS sobre la germinación in vitro de Ugni molinae. Bosque, 35(1), 119-122. 2014.
[41]Silva, B., Nogueira, J., Vieira, E., y Panobianco, M. Critérios para condução do teste de tetrazólio em sementes de araucária. Pesq. Agropec. Bras, 51(1), 61-68. 2016.
[42]Brasil, Ministério da Agricultura, Pecuária e Abastecimento. Regras para análise de sementes, MAPA, Brasília, pp 395. 2009.
[43]Grzybowski, C., Ohlson, O., Silva, R., y Panobianco. M. Viability of barley seeds by the tetrazolium test. Revista Brasileira de Sementes, 34(1), 47-54. 2012.
[44]Ríos, C., Orantes, C., Moreno, A., y Farrera R. Viabilidad y germinación de semillas de Jopi Ochroma pyramidale (Cav. ex Lam.) Urb. (Malvaceae). Lacandonia, 10(2), 7-11. 2016.
[45]Gaspar, C., Martins, C., y Nakagawa, J. Concentração da solução de tetrazólio e período de coloração do teste para sementes de mamoneira. Rev. Bras. Sementes, 23(3), 38-47. 2009.
[46]Donohue, K., Rubio, R., Burghardt, L., Kovach, K., et al. Germination postgermination adaptation and species ecological ranges. Annu Rev Ecol Evol Syst, 41(1), 293-319. 2010.
[47]Elizalde, V., García, J., Peña, C., Ybarra, M., Leyva, O., et al. Viabilidad y germinación de semillas de Hechtia perotensis (Bromeliaceae). Revista de Biología Tropical, 65(1), 153-165. 2017.
[48]Agüero, C., Pereyra, G., y Rolando, R. Método alternativo de germinación para determinar la calidad de semillas en Buffel Grass (Cenchrus ciliaris L.). Agriscientia, 34(1), 47-58. 2017.
[49]Checovich, M., y Ruiz, M. Variación en el nivel de dormición de la semilla en distintas variedades de la forrajera estival Panicum virgatum L. Revista de Investigación Agropecuaria, 38(2), 165-170. 2012.
[50]Salinas, A., Yoldjian, A., Craviotto, R., y Bisaro, V. Pruebas de vigor y calidad fisiológica de semillas de soja. Pesq. Agropec. Bras, 36(2), 371-379. 2001. DOI: 10.1590/S0100-204X2001000200022.
[51]Iossi, E., Vitti, F., Guilherme, B., Marani, R. & Daiton, R. Chemical composition and tetrazolium test of Syagrus romanzoffiana (Cham.) Glassman seeds. Rev. Bras. Frutic, 38(4), e-550. 2016. Doi: 10.1590/0100-29452016550.
[52]Andrade, S., y Laurentín, H. Efecto del nitrato de potasio sobre la germinación de semillas de tres cultivares de ají dulce (Capsicum chinense Jacq.). Rev. Unell. Cienc. Tec, 33(1), 25-29. 2015.
[53]Enríquez, E., Suzán, H., y Malda, G. Viabilidad y germinación de semillas de Taxodium mucronatum (ten.) en el estado de Querétaro, México. Agrociencia, 38(1), 375-381. 2004.
[54]Hernández, S., Ricardo, G., López, F., Parra, S., et al. Variación en la germinación entre poblaciones y plantas de chile silvestre. Agrociencia, 44(6), 667-677. 2010.
[55]Monroy, M., Peña, C., García, J., Solano, E., Campos, H. et al. Imbibición, viabilidad y vigor de semillas de cuatro especies de opuntia con grado distinto de domesticación. Agrociencia, 51(1), 27-42. 2017.
[56]Victoria, T., Bonilla, C., y Sánchez, O. Viabilidad en tetrazolio de semillas de caléndula y eneldo. Acta Agronómica, 55(1), 31-41. 2006.
[57]International Seed Testing Association. International Rules for Seed Testing. Basserdorf, CH Switzerland, 300 p. 2010.
[58]International Seed Testing Association. International Rules for Seed Testing, Fiona Hay (Chief Editor). Basserdorf, CH Switzerland, 15-70. 2014.
[59]Martínez, M., Cardozo, C., y Sánchez. M. Respuesta fisiológica de semillas de tomate Solanum lycopersicum L. var. Unapal - Maravilla y pimentón Capsicum annuum L. Var Unapal-Serrano en crioconservación. Acta Agronómica, 59(4), 401-409. 2010.
[60]Mathad, R., Basavegowda, S., y Vasudevan, S. Occurrence of "Fish Mouth" Seeds in Hot Pepper (Capsicum annum L.) and Effect on Seed Quality. Vegetos, 26(2), 353-356. 2013.
[61]Ruiz, M. A. El análisis de tetrazolio en el control de calidad de semillas. Caso de estudio: Cebadilla chaqueña. INTA. 2005. DOI: 10.13140/RG.2.1.2015.2160.
[62]Salazar Mercado, S., Quintero Caleño, J., y Rojas Suárez, J. Optimization of the tetrazolium test in three species of orchids of the Andean forest. Australian Journal of Crop Science, 14(5), 822-830. 2020. doi: 10.21475/ajcs.20.14.05.p2276.