http://dx.doi.org/10.15649/2346030X.2474
Propiedades físicas de estructuras tipo perovskita: Síntesis y aplicaciones.
Physical properties of perovskite-like structures: Synthesis and applications.
Carlos Ramírez-Martín1
Diego Figueredo-Amaya2
Jairo Mesa-Chaparro3
Alejandra Maria Rios-Rojas4
-
Universidad de Boyacá – Colombia. E-mail: cramirezm@uniboyaca.edu.co Autor de correspondencia
- Universidad de Boyacá – Colombia
- Universidad Pedagógica y Tecnológica de Colombia – Colombia
Recibido: 14 de julio de 2020.
Aprobado: 11 de noviembre de 2020.
Resumen—Los materiales tipo perovskita han despertado gran interés dada la flexibilidad que poseen para acomodar elementos de diferentes radios iónicos, permitiéndoles ser estable. Ello ha conllevado al estudio de familias específicas, nombradas de acuerdo al catión de menor radio iónico en la estructura, tal es es el caso de materiales basados en cobalto (cobaltitas), en manganeso (manganitas), en hierro con bismuto (ferritas de bismuto), en iridio (iridiatos). En el presente trabajo se realiza una breve descripción de la estructura perovskita, de igual forma se detallan las características básicas de algunas familias que han sido importantes por su contribución en el campo de la ciencia básica y aplicaciones, dentro de los cuales se menciona los materiales superconductores de alta temperatura crítica basados en cobre, y se describen algunos métodos importantes de síntesis por vía húmeda y seca. Se obtiene que, de acuerdo con sus elementos constituyentes, las propiedades exhibidas por cada material son diferentes y variadas, y por tanto, es posible encontrar materiales aplicados desde sensores, hasta los aplicados en catálisis. Aun cuando su respuesta sea variada, desde el punto de vista estructural, todos los materiales comparten el ordenamiento de octaedros conectados por vértices que encierran el catión de mayor tamaño.
Palabras clave: perovskita, manganita, cobaltita, cupratos.
Abstract—Perovskite-type materials have aroused great interest given the flexibility they have to accommodate elements of different ionic radii, allowing them to be stable. This has led to the study of specific families, named according to the cation with the lowest ionic radius in the structure, such is the case of materials based on cobalt (cobaltites), on manganese (manganites), on iron with bismuth (bismuth ferrites), in iridium (iridiatos). In the present work a brief description of the perovskite structure is made, in the same way the basic characteristics of some families that have been important for their contribution in the field of basic science and applications are detailed, within which the materials are mentioned. copper-based high critical temperature superconductors, and some important dry and wet synthesis methods are described. It is obtained that according to its constituent elements, the properties exhibited by each material are different and varied, and therefore, it is possible to find materials applied from sensors, to those applied in catalysis. Even when your answer is varied, from the structural point of view, all materials share the order of octahedra connected by vertices that enclose the largest cation.
Keywords: perovskite, manganite, cobaltite, cuprates.
La comunidad científica del área de la ciencia de los materiales en los últimos años ha despertado un gran interés por los materiales nonoestructurados, dado que sus propiedades físicas y químicas difieren de las de los materiales masivos ya que están basadas en efectos de tamaño cuántico [1]. Por tanto, un área de interés en el procesamiento de materiales es la elaboración de materiales cerámicos avanzados, tal es el caso de las perovskitas que presentan una gran variedad de propiedades como la conductividad iónica [2], la superconductividad [3], la magnetorresistencia [4], la ferroelectricidad [5], entre otras. Bajo estas propiedades, por ejemplo, las perovskitas de tierras alcalinas son utilizadas como cerámicos eléctricos, pilas de combustible de óxido sólido, materiales refractarios y sensores de hidrogeno [6].
En el contexto mundial se buscan alternativas en la generación de energía renovable, dispositivos más eficientes, materiales avanzados utilizados en los procesos de remediación de suelos, agua y aire, entre otras [7], y las perovskitas han resultado una opción eficaz. Los óxidos tipo perovskita por sus características estructurales han despertado un gran interés, dado que su estructura permite incorporar iones, los cuales mejoran sus propiedades fotocatalíticas lo que los convierte en candidatos potenciales para sustituir al fotocalizador comercial TiO2 utilizado actualmente [8] [9] [10] y [11].
Como las estructuras tipo perovskita se preparan por el método de reacción de estado sólido, sus propiedades estructurales se ven afectadas y esto se refleja en la disminución de la eficiencia en reacciones fotocataliticas. Atendiendo a ello, en los últimos años, la comunidad científica ha desarrollado métodos alternativos dentro de los cuales se pueden citar el sol-gel referidos por [12], [13] y [14], las microondas [15], el electrohilado [16], el hidrotermal [17], el solvotermal [18], la polimerización compleja [19] y el hidrotermal [20].
En función de la riqueza científica de estos materiales, el presente artículo tiene como objetivo desarrollar una descripción de la estructura perovskita, detallando las características básicas de algunas familias que han sido importantes por su contribución en el campo de la ciencia básica y aplicaciones. Para ello, se desarrolla un estudio cualitativo de revisión documental con fuentes del contexto mundial, permitiendo un resultado contentivo de dos apartados clave: la explicación de la estructura de tipo perovskita, y los métodos de síntesis, todo lo cual se expone a continuación.
a) Estructura tipo perovskita
Los materiales tipo perovskita tienen forma general ABX3 donde A y B son cationes metálicos y X es un ion no metálico [21], el más común es el oxígeno. Por lo general el radio iónico del catión A es mayor al radio iónico del catión B [22]. La estructura ideal es de simetría cúbica, con el átomo A ubicado en el centro de la estructura, el átomo B en las esquinas del cubo y los átomos X en las aristas del cubo [23].
El nombre perovskita se debe al mineral CaTiO3 (perovskita) descubierto en 1839 por Gustav Rose y nombrado así en honor a Lev Alexevich von Perovski [24] [25]. La estructura de la perovskita es usual describirla como un arreglo de octaedros BO6 conectados por átomos de oxígeno, el octaedro es formado por átomos de oxígeno los cuales encierran en su interior el catión B, el átomo A se encuentra en el centro de la celda como se aprecia en la Figura 1.
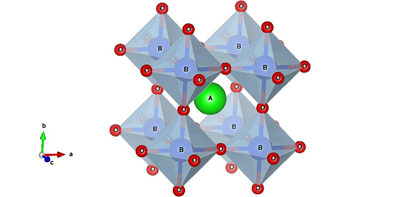
Figura 1: Representación octaédrica de la estructura tipo perovskita.
Fuente: Extraído de [26].
Por la gran variedad de cationes que la estructura puede acomodar se encuentran que los materiales tipo perovskita tienen propiedades que los hace útiles en aplicaciones de energía, grabación magnética, sensores, entre otros [27]. Un primer parámetro para establecer la estabilidad desde el punto de vista estructural es el factor de tolerancia, descrito por la Ecuación (1) [28], donde RA, RB y RO son los radios iónicos de los átomos A, B y oxígeno respectivamente. Si el valor de t se encuentra entre 0,75 y 1, la estructura es estable. Para que la estructura sea estable debe cumplirse también que sea eléctricamente neutra [22].
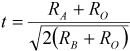 (1)
(1)
A continuación, se describen los tipos de estructuras perovskita.
Cobaltitas. Dentro de las perovskitas de mayor interés científico, se pueden citar los materiales basados en elementos de valencia mixta como el Mn y el Co que forman las perovskitas CaMnO3-d y LaCoO3-d. En el caso del ion Co+3, éste puede presentar transiciones del estado de espín en un entorno octaédrico cuando son sometidos a un estímulo externo, teniendo la posibilidad de estar en una configuración de espín bajo, LS, (low spin, en donde S=0 en una configuración t2g6), espín intermedio, MS (intermediate spin IS, en donde S=1 en una configuración t2g5 eg1) y espín alto, HS (high spin HS, en donde S=2 en una configuración t2g4 eg2) [29]. Dentro de las propiedades físicas que exhiben estos materiales se puede mencionar transiciones metal-aislante en el sistema Pr0.5Ca0.5CoO3 [30].
Manganitas. En el caso de las manganitas, AMnO3, cuando se realizan sustituciones en la posición del catión A por elementos divalentes, se inducen estados de valencia mixta entre los iones de Mn, presentándose en la red porciones de Mn+4 (S=3/2) y porciones de Mn+3 (S=2), lo cual genera interacciones de doble intercambio y distorsiones en la red debidas a la introducción de iones con diferente radio iónico en comparación al ion A original [31]. Lo anterior provoca que los materiales presenten diagramas de fase complejos, donde existe la posibilidad de encontrar estados de ordenamiento de carga [32] [33], ordenamiento orbital [34] [35], estados antiferromagnéticos con estados metálicos [36] o ferromagnéticos con estados metálicos [37] y la aparición de magnetoresistencia colosal [38] [39].
Ferroeléctricos. Otra propiedad importante que se puede presentar en materiales con estructura tipo perovskita es la ferroelectricidad. La ferroelectricidad está estrechamente relacionada con las propiedades estructurales del material, cuando ocurre un desplazamiento relativo entre los cationes A y B respecto a los oxígenos se produce una separación de carga lo cual da origen a la formación de una polarización espontánea en la celda unitaria. La polarización espontánea está ligada a los materiales que cristalizan en un grupo espacial polar no centrosimétrico a baja temperatura, cuando se sobrepasa cierto valor de temperatura, denominada temperatura de Curie, el material presenta una transición de fase estructural a un grupo espacial no polar centrosimétrico convirtiendo la respuesta eléctrica del material en paraeléctrico [40] [41].
Organometálicos. Recientemente otro tipo de materiales basados en la estructura perovskita son los compuestos denominados híbridos orgánicos-inorgánicos (OHPs organic-inorganic hybrid perovskites) paraeléctrico [42], aplicados en celdas solares, éstos materiales en forma de película delgada son denominados celdas solares tipo perovskita, cuya sigla en inglés es PSCs (perovskite sollar cells) [43]. En éste tipo de materiales el catión B es un catión metálico divalente, X es un haluro (Cl, Br o I), mientras que el sitio A lo ocupa un catión orgánico de tipo metilamonio, que corresponde a una cadena orgánica que separa las capas de octaedros [44]. Uno de los materiales más estudiados es el basado en ion Pb2+ en la posición del catión B, en donde el principal campo de aplicación es en optoelectrónica, su fórmula general es de la forma CH3NH3PbX3(X = I, Br, Cl) [45].
Cupratos y Superconductividad. Una familia importante de materiales basados en la estructura tipo perovskita son los superconductores basados en Cu de alta temperatura crítica. El fenómeno de superconductividad fue descubierto en 1911 por [46]. En 1986 se reportó el material La1.8Ba0.2CuO4, éste posee una estructura basada en el material K2NiF4, el cual corresponde a un compuesto con estructura laminar tipo perovskita [24] [46], éste material exhibía el fenómeno de superconductividad a 35 K, a partir de este trabajo surgió gran interés por los materiales superconductores generando una carrera con lo que se conoce hoy como superconductores de alta temperatura crítica.
Con base en el referido trabajo, se produjo el primer superconductor con temperatura crítica superior a la temperatura de nitrógeno líquido, donde reemplazaron el átomo de lantano por átomo de itrio, el material de fórmula química YBa2Cu3O7-d es conocido como superconductor tipo 1-2-3 [24]. La estructura del superconductor Y1-2-3 se puede observar en la Figura 2.
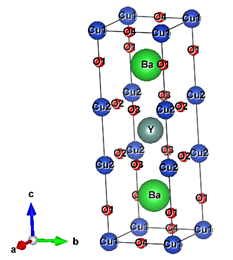
Figura 2: Representación de la estuructra Y1-2-3.
Fuente: [26].
En la estructura ideal de la perovskita, el átomo A está coordinado por 12 átomos X ubicados en la mitad de las aristas de la celda y por 8 átomos B en las esquinas de la celda. En el caso del 1-2-3 se puede idealizar la estructura formada de 3 celdas de la forma ABO3, una central de YCuO3 y 2 en los extremos de BaCuO3, lo que llevaría a una estructura teórica de fórmula YBa2Cu3O9, sin embargo, ésta estructura no es probable debido a los estados electrónicos del Cu. En la estructura ideal del YBa2Cu3O7-d cuando d=0, en la celda central, el átomo Y está coordinada por 8 átomos de oxígeno y 8 de cobre. En las celdas de los extremos el átomo de Ba está coordinado por 10 átomos de oxígeno y 8 átomos de cobre.
Una manera alterna de representar la estructura es a partir de la construcción de planos de CuO2 separados por el átomo de Y, donde los planos están conectados por cadenas de CuO que se encuentran a lo largo de la dirección cristalográfica c como se aprecia en la Figura 3. Para la estructura mostrada del sistema Y1-2-3, el grupo espacial es ortorrómbico Pmmm [46]. En ésta configuración el sistema es superconductor.
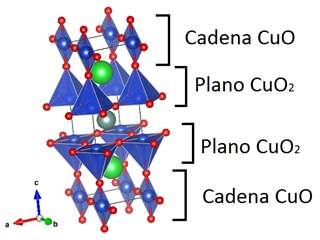
Figura 3: Representación de las cadenas de CuO y planos de CuO2 en la estructura Y1-2-3.
Fuente: [26].
En la Tabla 1 se presentan las posiciones atómicas de los diferentes elementos.
Tabla 1: Posiciones atómicas en el compuesto Y1-2-3.
Átomo |
Rotúlo |
X |
Y |
Z |
Posición Wyckoff |
Y |
Y |
0.5 |
0.5 |
0.5000 |
1h |
Ba |
Ba |
0.5 |
0.5 |
0.1910 |
2t |
Cu |
Cu1 |
0.0 |
0.0 |
0.0000 |
1a |
Cu |
Cu2 |
0.0 |
0.0 |
0.3630 |
2q |
O |
O1 |
0.0 |
0.0 |
0.1490 |
2q |
O |
O2 |
0.5 |
0.0 |
0.3823 |
2s |
O |
O3 |
0.0 |
0.5 |
0.3703 |
2r |
O |
O4 |
0.0 |
0.5 |
0.0000 |
1e |
Fuente: [47].
En el sistema 1-2-3 la tierra rara está rodeada por 2 planos de CuO2. Por la parte inferior y superior de la celda se encuentran planos de BaO seguidos por las cadenas de CuO, las capas formadas por éstas dos últimas se denominan reservorios de carga, los cuales son los encargados de introducir los portadores de carga en los planos de CuO2. Cuando d es diferente de cero, los oxígenos faltantes en la celda se encuentran en los que forman las cadenas de CuO, dependiendo del valor de d la estructura puede presentar una transición estructural desde un sistema ortorrómbico a un sistema tetragonal [48].
El sistema LaBaCaCu3Ox es un superconductor de forma 1-2-3 similar al YBaCu3O7-d con temperatura crítica de 79(1) K. En este sistema los iones de La y Ca están distribuidos en las posiciones de los iones de Y y Ba. En este caso la estructura es tetragonal para cualquier valor de d, presentándose la superconductividad en éste para d=0,15 [47].
El LaCaBaCu3O7-d es denominado un superconductor de tipo TR:1113 [48]. A partir de este sistema se han reportado diferentes trabajos donde se han realizado estudios del análisis de las diferentes propiedades estructurales para los sistemas La1.5-xBa1.5+x-yCayCu3Oz [47] [49], La1−xBaxCuO3−y [50], (CaxLa1-x)(Ba1.75-xLa0.25+x)Cu3Oy [50], CaLaBaCu307; estudio de las propiedades eléctricas en el sistema (CaxLa1-x)(Ba1.75-xLa0.25+x)Cu3Oy [52] [53] [54] y [55]; estudio de las fluctuaciones en la conductividad en los sistemas La0.5RE0.5BaCaCu3O7−δ E=(Y,Sm,Dy) [56], Yb0.6Sm0.4Ba2Cu3O7-δ [57]; estudios de la influencia de la presión en las temperaturas de transición (CaxLa1-x)(Ba1.75-xLa0.25+x)Cu3Oy [58]; estudio de la línea de irreversibilidad en el compuesto Y1-xLuxBa2Cu3O7-δ [59]; estudios en las fluctuaciones de la magnetización en CaLaBaCu3O7-d [60]. Otros sistemas basados en el material LaCaBaCu3O7-d que han sido estudiados son de la forma (CaxR1-x)(Ba3-z-xRz-(1-x))Cu3Oy (R=La, Nd) [61].
b) Metodos de sintesis
Los métodos y técnicas empleadas para la producción de materiales tipo perovskita son variados. La elección de un método en particular, está estrechamente relacionado con la propiedad específica que se desee para una aplicación en particular. Por ejemplo, para el favorecimiento de propiedades eléctricas y magnéticas se recurre a métodos de producción físicos que permiten obtener tamaños de grano mayores en comparación a métodos químicos y, si se desea favorecer propiedades ópticas se recurre en gran medida a procesos de síntesis químicos. A continuación, se describen los métodos reportados en la literatura.
Método sol-gel. El método sol gel es uno de los procesos más usados para la obtención de películas delgadas a partir de una solución homogénea, la cual es depositada sobre un sustrato empleando una técnica, donde las más comunes son spin casting y dip coating. En seguida, los materiales depositados junto con el sustrato son sometidos a tratamientos térmicos para la cristalización del material. El proceso sol-gel se basa en reacciones de hidrólisis y condensación de los reactantes involucrados. Este método además permite obtener polvos cerámicos en tamaños nanométricos [62] [63]. En la actualidad el método es común en la preparación de perovskitas hibridas con aplicaciones en dispositivos fotovoltaicos [64].
Método de combustión. El método de combustión es un proceso exotérmico, en donde se hace uso principalmente de nitratos metálicos, un combustible orgánico y en ocasiones agua como solvente. La mezcla de los precursores es seguida por un calentamiento a baja temperatura que favorece la combustión de los reactantes, en este instante y por un período corto de tiempo se alcanzan temperaturas elevadas junto con la liberación de gases, por ejemplo, CO2, H2O y N2. Este método permite obtener materiales nanométricos con altas áreas superficiales [65]. Con este método se han producido materiales tipo perovskita del compuesto LaBa2Cu3O7-d [66].
Método de reacción en estado sólido. Este método es una de las técnicas de síntesis más usadas para la obtención de materiales policristalinos. En el proceso se emplean generalmente óxidos, carbonatos o nitratos, éstos se mezclan y son llevados a tratamiento térmico a elevadas temperaturas. El método se basa en la inter-difusión atómica de los reactantes [62]. El método ha sido empleado para la síntesis de una gran variedad de materiales, desde manganitas [67] [68]; hasta superconductores [54] [55].
Síntesis por plasma. Usualmente el plasma se utiliza para la obtención de películas, en esta clase de proceso los precursores en polvo son inyectados en una cámara y fundidos en un arco de plasma [69], existen variantes en donde se recolectan las partículas [62]. Una forma de producir plasma es a través de una descarga eléctrica, en esta forma, se puede obtener un plasma térmico o un plasma frio, el cual está relacionado con un plasma en equilibrio y otro en no equilibrio termodinámico, respectivamente [70]. En el caso del plasma térmico, éste ha sido utilizado en el crecimiento de materiales cristalinos, en la técnica de deposición por pulverización, en la obtención de polvos y en la sinterización de materiales [71]. Recientemente se ha empleado un tipo de plasma, descarga luminiscente anormal, para tratamientos de sinterización de materiales [57].
Síntesis hidrotermal. El proceso hidrotermal es una una reacción química heterogénea que se lleva a cabo en presencia de un solvente que puede ser acuoso o no y la cual se realiza por encima de la temperatura ambiente y condiciones de presión superior a una atmosfera en un sistema cerrado [72]. Las técnicas fundamentadas en métodos hidrotermales involucran a un precursor metálico disuelto en un líquido, en un recipiente cerrado, que es calentado por encima de su punto de ebullición, lo que genera una presión superior a la atmosférica. Una característica de los procesos hidrotermales consiste en que los reactivos que difícilmente se disuelven en el agua pasan a la disolución por acción del propio disolvente.
El objetivo de esta técnica es en primera instancia lograr una mejor disolución de los componentes de un sistema y así hacer reaccionar especies muy poco solubles en condiciones habituales. El agua en estas condiciones actúa como agente reductor por lo que cabe esperar variaciones en el estado de oxidación de los elementos utilizados en la síntesis [73]. Una de las principales ventajas de la técnica hidrotermal sobre la de reacción de estado sólido es la baja temperatura de reacción; por otra parte, la técnica brinda la obtención de materiales cristalinos y nanoestructurados con alta pureza y control microestructural de los productos [74].
Síntesis hidrotermal asistida por microondas. Los primeros estudios sobre la sintesis hidrotermal de materiales asistida por microondas se llevó a cabo por Komarneni [73], quien sintetizó una serie de partículas cerámicas y electroceramicas. Las características más destacadas de este método están relacionadas con los tiempos de reacción más cortos, obtención de partículas finas y monodispersas como resultado del calentamiento volumétrico, el cual elimina los gradientes térmicos que se presentan en el caso del calentamiento convencional.
La utilización de microondas para la síntesis de solidos inorgánicos presenta grandes beneficios de ahorro energético, mayor rendimiento, procedimiento económico y respetuoso con el medio ambiente. Se han sintetizado por microondas perovskitas base lantano LaMO3 utilizadas en pilas de combustible de óxido sólido, membranas de separación, materiales magnetópticos y magneto resistente y catalizadores. En la cromita LaCrO3 se puede se puede seguir el mecanismo de reacción puesto que a 500 °C se forman fases con estructura conocida y aumentando la temperatura tiene lugar la perovskita lo cual se consigue con un tratamiento de 30 minutos de microondas [72] [74].
Electro hilado. La técnica de electro hilado ha sido utilizada para la fabricación de componentes en las pilas de combustible de óxido solido [75], se presenta como una óptima técnica de fabricación dado que constituye un medio continuo para el transporte de cargas, gracias a una elevada superficie, una refinada permeación de gases y una alta densidad de puntos triples [76]. El método de electro hilado está fundamentado en la aplicación de un campo eléctrico entre la punta de una jeringa y el colector de corriente.
Cuando la tensión superficial de la disolución precursora es superada por la fuerza producida por el campo eléctrico se forma una estructura cónica en la punta de la aguja y empiezan a salir fibras direccionadas hacia el colector [77]. En la medida en que el disolvente se evapora las fibras producidas se alargan lo cual la convierte en una técnica de bajo costo, muy eficiente y escalable a nivel industrial para la producción de materiales a escala manométrica y micrométrica, la técnica de electro hilado se ha posicionado en aplicaciones para biomedicina y variados procesos de filtración [38] [78] [79].
Como se observa, en la literatura se encuentra una variedad de investigaciones sobre materiales tipo perovskita fundamentadas en el ordenamiento estructural y características básicas. Se destacan las cobaltitas y manganitas, dos familias que son importantes desde el punto de vista científico por la fenomenología que presentan, debido al comportamiento de valencia mixta que exhiben el Co y el Mn. En la actualidad, un grupo de gran interés es el relacionado con las perovskitas organometálicas dado su gran potencial para la aplicación en la tecnología de celdas solares por el incremento en su eficiencia y la posibilidad de obtener energía eléctrica de forma sustentable
Dado el avance en los métodos de síntesis y la variación en las técnicas de producción se han obtenido características interesantes y diferentes a las reportadas en un mismo material, tal es el caso de los superconductores de alta temperatura crítica basados en cupratos cuyos posibles mecanismos para la superconductividad siguen siendo objeto de considerable debate y de variadas investigaciones.
[1] A, Henglein, “Small-particle research: physicochemical properties of extremely small colloidal metal and semiconductor particles”. Chemical Reviews, vol. 89, n°. 8, pp. 1861-1873, 1989. https://doi.org/10.1021/cr00098a010
[2] Y. Inaguma, C. Liquan, M. Itoh, T. Nakamura, T. Uchida, H. Ikuta y M. Wakihara, “High conductivity in lithium lanthanum titanate”. Solid State Común, vol. 86, n° 1, pp. 689-693, 1993. https://doi.org/10.1016/0038-1098(93)90841-A
[3] H. Fukuoka, T. Isami y S. Yamanaka, “Superconductivity of alkali metal intercalated niobate with a layered perovskite structure”. Chem. Lett., vol. 8, n° 1, pp. 703-704, 1997. https://doi.org/10.1246/cl.1997.703
[4] Y. Moritomo, A. Asamitsu, H. Kuwahara y Y. Tokura, “Giant magnetoresistance of manganese oxides with a layered perovskite structure”. Nature, vol. 380, n° 1, pp. 141-144, 1996. https://doi.org/10.1038/380141a0
[5] W. Schulze, J. Biggers y L. Cross, “Aging of dielectric dispersion in PLZT relaxor ceramics”. J. Am. Ceram. Soc., vol. 61, n° 1, pp. 46-9, 1996. https://doi.org/10.1111/j.1151-2916.1978.tb09227.x
[6] H. Iwara, T. Yajima, T. Hibino, K. Ozaki y H. Suzuki, “Protonic conduction in calcium, strontium and barium zirconates”. Solid State Ionics, vol. 61, n°. 1-3, pp. 65-69, 1993. https://doi.org/10.1016/0167-2738(93)90335-Z
[7] L. Torres, I. Juárez, X. García, A. Cruz, “Desarrollo de semiconductores con estructuras tipo perovskitas para purificar el agua mediante oxidaciones avanzadas”. Ciencia UANL, vol. 13, n°. 4, pp. 376-388, 2010.
[8] H. Kato, H. Mikihiro, K. Ryoko, S. Yoshiki y K. Akihiko, “Construction of Z-scheme Type Heterogeneous Photocatalysis Systems for Water Splitting into H2 and O2 under Visible Light Irradiation”. Chem. Lett., vol. 33, n°. 10, pp. 1348-1349, 2004. https://doi.org/10.1246/cl.2004.1348
[9] A. Kudo, H. Kato y H. Kobayasi, “Role of Ag+ in the Band Structures and Photocatalytic Properties of AgMO3 (M: Ta and Nb) with the Perovskite Structure”. J. Phys. Chem. B, vol. 106, n°. 48, pp. 12441-12447, 2002. https://doi.org/10.1021/jp025974n
[10] A. Kudo, H. Kato y S. Nakagawa, “Water Splitting into H2 and O2 on New Sr2M2O7 (M=Nb and Ta) Photocatalysts with Layered Perovskite Structures: Factors Affecting the Photocatalytic Activity”. J. Phys. Chem. B, vol. 104, n°. 3, pp. 571-575, 2000. https://doi.org/10.1021/jp9919056
[11] A. Kudo, M. Yugo y K. Hideki, “Water Splitting into H2 and O2 over Ba5Nb4O15 Photocatalysts with Layered Perovskite Structure Prepared by Polymerizable Complex Method”. Chem. Lett., vol. 35, n°. 9, pp. 1052-1053, 2006. https://doi.org/10.1246/cl.2006.1052
[12] L. Torres, L. Garza, M. Meza, A. Martínez y A. Cruz, "Photocatalytic Activity of Doped NaTaO3 and NaNbO3: (Y, La, Nd, Sm) Sol Gel on Degradation of Rhodamine B by UV Irradiation". Mater. Sci. Forum, vol. 544-545, n° 1, pp. 103-106, 2007. https://doi.org/10.4028/www.scientific.net/MSF.544-545.103 (15)
[13] W. Lin, C. Cheng, C. Hu y H. Teng, “NaTaO3 photocatalysts of different crystalline structures for water splitting into H2 and O2”. Appl. Phys. Lett., vol. 89, n° 21, pp. 211904, 2006. https://doi.org/10.1063/1.2396930
[14] H. Teng y C. Hu, “Influence of structural features on the photocatalytic activity of NaTaO3 powders from different synthesis methods”. Appl. Catal. A-Gen., vol. 331, n° 1, pp. 44-50, 2007. https://doi.org/10.1016/j.apcata.2007.07.024
[15] Z. Zou, C. Yan, Z. Wang y Z. Li, “Photocatalytic activities for water splitting of La-doped-NaTaO3 fabricated by microwave synthesis”. Solid State Ionics, vol. 180, n° 32-35, pp. 1539-1542, 2009. https://doi.org/10.1016/j.ssi.2009.10.002
[16] H. Cheng, X. Wang, G. Liu, Z. Chen, F. Li y G. Lu, “Synthesis and Photoelectrochemical Behavior of Nitrogen-doped NaTaO3”. Chem. Lett., vol. 38, n° 3, pp. 214-215, 2009. https://doi.org/10.1246/cl.2009.214
[17] G. Chen, C. Zhou, Y. Li, H. Zhang y J. Pei, “Photocatalytic activities of Sr2Ta2O7 nanosheets synthesized by a hydrothermal method”. Int. J. Hydrogen Energ, vol. 34, n° 5, pp. 2113-2120, 2009. https://doi.org/10.1016/j.ijhydene.2008.12.074
[18] A. Kudo, H. Kato, K. Asakura, “Highly Efficient Water Splitting into H2 and O2 over Lanthanum-Doped NaTaO3 Photocatalysts with High Crystallinity and Surface Nanostructure”. J. Am. Chem. Soc., vol. 125, n° 10, pp. 3082-3089, 2003. https://doi.org/10.1021/ja027751g
[19] K. Rajeshwar, “Hydrogen generation at irradiated oxide semiconductor–solution interfaces”. J. Appl. Electrochem., vol. 37, n°. 7, pp. 765-787, 2007. https://doi.org/10.1007/s10800-007-9333-1
[20] A. Fujishima, X. Zhanga y D. Trykbet, “Heterogeneous photocatalysis: From water photolysis to applications in environmental cleanup”. Int. J. Hydrogen Energ., vol. 32, n° 14, pp. 2664-2672, 2007. https://doi.org/10.1016/j.ijhydene.2006.09.009
[21] R. Pérez, “A Structural Parameter for High Tc Superconductivity from an Octahedral Möbius Strip in RBaCuO: 123 type Perovskites”. Revista Mexicana de Física, vol. 48, n° 1, pp. 262-267, 2002.
[22] J. Sunarso, S. Hashim, N. Zhu y W. Zhou, “Perovskite oxides applications in high temperature oxygen separation, solid oxide fuel cell and membrane reactor: A review”. Progress in Energy and Combustion Science, vol. 61, pp. 57-77, 2017. https://doi.org/10.1016/j.pecs.2017.03.003
[23] R. Hazen, “Perovskites”. Scientific American, vol. 258, n° 1, pp. 74-81, 1988.
[24] N. Atta, A. Galal y E. El, “Perovskite Nanomaterials – Synthesis, Characterization, and Applications”. London: Intech, 2016.
[25] P. Gao, M. Grätzela y M. Nazeeruddin, “Organohalide lead perovskites for photovoltaic applications”. Energy Environ. Sci, vol. 7, n° 8, pp. 2448-2463, 2014. https://doi.org/10.1039/C4EE00942H
[26] E. Moore, “Solid State Chemistry. An Introduction”. London: Taylor & Francis Group, 2005.
[27] P. Wagner, G. Wackers, L. Cardinaletti, J. Manca y J. Vanacken, “From colossal magnetoresistance to solar cells: An overview on 66 years of research into perovskites”. Physica Status Solidi A, vol. 214, n° 9, pp. 1700394, 2017. https://doi.org/10.1002/pssa.201700394
[28] V. Goldschmidt, “Die Gesetze der Krystallochemie”. Die Naturwissenschaften, vol. 14, n°. 21, pp. 477-485, 1926. https://doi.org/10.1007/BF01507527
[29] A. Barón, C. Frontera, J. García, J. Blasco, C. Ritterc, S. Valenciad, R. Feyerhermd y E. Dudzikd, “Exploration of magnetic order in Pr0.5Ca0.5CoO3- (=0) below the metal-insulator transition”. Physics Procedia, vol. 8, n° pp. 73-77, 2010. DOI: 10.1016/j.phpro.2010.10.014
[30] A. Barón, J. García, J. Herrero y C. Frontera, “Ground State and the Metal-insulator Transition in (Pr1−yYy)1−xCaxCoO3, (0.45 ≤ x ≤ 0.55) Cobaltites”. Journal of the Korean Physical Society, vol. 63, n° 3, pp. 791-794, 2013. https://doi.org/10.3938/jkps.63.791
[31] Y. Tokura y Y. Tomioka, “Colossal magnetoresistive manganites”. Journal of Magnetism and Magnetic Materials, vol. 200, n° 1-3, pp. 1-23, 1999. https://doi.org/10.1016/S0304-8853(99)00352-2
[32] Ch. Renner, G. Aeppli, B. Kim, Y. Soh y S. Cheong, “Atomic-scale images of charge ordering in a mixedvalence manganite”. Nature, vol. 416, n° 1, pp. 518-521, 2002. https://doi.org/10.1038/416518a
[33] Y. Moritomo, H. Kuwahara y Y. Tomioka, “Pressure effects on charge-ordering transitions in Perovskite manganites”. Physical Review B, vol. 55, n° 12, pp. 7549-7556, 1997. https://link.aps.org/doi/10.1103/PhysRevB.55.7549
[34] C. Ling, J. Millburn, J. Mitchell, D. Argyriou, J. Linton y H. Bordallo, “Interplay of spin and orbital ordering in the layered colossal magnetoresistance manganite La2-2xSr1+2xMn2O7 (0.5<x<1.0)”. Physical Review B, vol. 62, n° 22, pp. 15096-15111, 2000. https://doi.org/10.1103/PhysRevB.62.15096
[35] Y. Murakami, H. Kawada, M. Tanaka, T. Arima, Y. Moritomo y Y. Tokura, “Direct Observation of Charge and Orbital Ordering in La0.5Sr1.5MnO4”. Physical Review Letters, vol. 80, n° 9, pp. 1932-1935, 1998. https://doi.org/10.1103/PhysRevLett.80.1932
[36] T. Akimoto, Y. Maruyama, Y. Moritomo y A. Nakamura, “Antiferromagnetic metallic state in doped manganites”. Physical Review B, vol. 57, n° 10, pp. 5594-5597, 1998. https://doi.org/10.1103/PhysRevB.57.R5594
[37] F. Ye, P. Dai, J. Fernandez, H. Sha, J. Lynn, H. Kawano, Y. Tomioka, Y. Tokura y J. Zhang, “Evolution of Spin-Wave Excitations in Ferromagnetic Metallic Manganites”. Physical Review Letters, vol. 96, n° 4, pp. 047204-047207, 2006. https://link.aps.org/doi/10.1103/PhysRevLett.96.047204
[38] K. Yun, C. Hogan, Y. Matsubayashi, M. Kawabe, F. Iskandar y K. Okuyama, “Nanoparticle filtration by electrospun polymer fibers”. Chem. Eng. Sci, vol. 62, n° 1, pp. 4751-4759, 2007. https://doi.org/10.1016/j.ces.2007.06.007
[39] Z. Zeng, M. Greenblatt y M. Croft, “Large magnetoresistance in antiferromagnetic CaMnO3-”. Physical Review B, vol. 59, n° 3, pp. 8784-8788, 1999. https://doi.org/10.1103/PhysRevB.59.8784
[40] K. Webber, M. Vögler, N. Khansur, B. Kaeswurm, J. Daniels y F. Schader, “Review of the mechanical and fracture behavior of perovskite lead-free ferroelectrics for actuator applications”. Smart Materials and Structures, vol. 26, no. 6, pp. 063001, 2017. https://doi.org/10.1088%2F1361-665x%2Faa590c
[41] K. Rabe, C. Ahn y J. Triscone, “Physics of Ferroelectrics: A Modern Perspective”. Topics Applied Physics, vol. 105, pp. 1-30, 2007.
[42] S. Dastidar, C. Hawley, A. Dillon, A. Gutierrez, J. Spanier y A. Fafarman, “Quantitative Phase-Change Thermodynamics and Metastability of Perovskite-Phase Cesium Lead Iodide”. The Journal of Physical Chemistry Letters, vol. 8, no. 6, pp. 1278-1282, 2017. https://doi.org/10.1021/acs.jpclett.7b00134
[43] G. Niu, X. Guo y L. Wang, “Review of recent progress in chemical stability of perovskite solar cells”. Journal of Materials Chemistry A, vol. 3, pp. 8970-8980, 2015. https://doi.org/10.1039/C4TA04994B
[44] R. Misra, B. Cohen, L. Iagher y L. Etgar, “Low-Dimensional Organic–Inorganic Halide Perovskite: Structure, Properties, and Applications”. Chemistry and Sustainability Energy and Materials, vol. 10, pp. 3712-3721, 2017. https://doi.org/10.1002/cssc.201701026
[45] V. Adinolfi, W. Peng, G. Walters, O. Bakr y E. Sargent, “The Electrical and Optical Properties of Organometal Halide Perovskites Relevant to Optoelectronic Performance”. Advanced Materials, vol. 30, n° 1, pp. 1700764, 2017. https://doi.org/10.1002/adma.201700764
[46] M. Tinkham, “Introduction to superconductivity”, New York: McGraw-Hill, Inc, 1996.
[47] W. Fu, H. Zandbergen, C. Van der Beek y L. de Jongh, “High-temperature superconductivity in LaBaCaCu3O6.85”. Physica C:uperconductivity, vol. 156, n° 1, pp. 133-136, 1988. https://doi.org/10.1016/0921-4534(88)90118-9
[48] C. Parra, “Fluctuaciones en las propiedades magnéticas y de magnetotransporte de superconductores de alta temperatura crítica”, [Tesis Doctoral], Bogotá: Universidad Nacional de Colombia, 2010.
[49] J. Skakle y A. West, “Superconducting La1.5−xBa1.5+x−yCayCu3Oz solid solutions I. Phase diagram, cation stoichiometry and Tc data”. Physica C: Superconductivity, vol. 220, n° 1-2, pp. 187-194, 1994. https://doi.org/10.1016/0921-4534(94)90900-8
[50] C. Dong, J. Liang, G. Che, S. Xie, Z. Zhao, Q. Yang, Y. Ni y G. Liu, “Superconductivity and crystal structure in the La-Ba-Cu-0 system”. Physical Review B, vol. 37, n° 10, pp. 5182-5185, 1988. https://doi.org/10.1103/PhysRevB.37.5182
[51] D. Goldschmidt, G. Reisner, Y. Direktovitch, A. Knizhnik, E. Gartstein, G. Kimmel y Y. Eckstein, “Tetragonal superconducting family (CaxLa1-x)(Ba1.75-xLa0.25+x)Cu3Oy. The effect of cosubstitution on the transition temperature”. Physical Review B, vol. 48, n° 1, pp. 532-542, 1993. https://doi.org/10.1103/physrevb.48.532
[52] S. Gurman, J. Amiss, S. Venkatesh, K. Kumari, R. Singhai, K. Garg, “A structural model for the CaLaBaCu307 superconductor from a detailed XAFS study”. Journal of Synchrotron Radiation, vol. 1, n° 6, pp. 761-763, 1999. https://doi.org/10.1107/S0909049599000266
[53] L. Corredor, D. Landínez, J. Rojas y J. Aguiar, “Structural Properties of CaLaBaCu3O7 Single Crystals Grown by Self-Flux Method”. Brazilian Journal of Physics, vol. 33, n° 4, pp. 733-736, 2003. http://dx.doi.org/10.1590/S0103-97332003000400019
[54] C. Parra, D. Landínez y J. Rojas, “Efectos de la Sustitución de Elementos de Tierra Raras en los Sitios de la del Superconductor LaBaCaCu3O7-δ.”, Revista Colombiana de Física, vol. 40, n° 1, pp. 29-31, 2008.
[55] A. Knizhnik, G. Reisner, I. Direktovich, G. Shter, G. Grader y Y. Eckstein, “Equilibrium of 1:2:3 CLBLCO superconductors with oxygen: effect of cooling upon the oxygen content and the homogeneity of its distribution”, Journal of Physics and Chemistry of Solids, vol. 64, n° 1, pp. 273-280, 2003. https://doi.org/10.1016/S0022-3697(02)00294-9
[56] C. Parra, Jr. Pimentel, P. Pureur, D. Landinez y J. Rojas, “Fluctuation Conductivity of La0.5RE0.5BaCaCu3O7− (RE= Y, Sm, Dy) Superconductor”. Journal of Superconductivity and Novel Magnetism, vol. 26, n° 1, pp. 2261-2264, 2013. https://doi.org/10.1007/s10948-012-1572-7
[57] A. Sarmiento, J. Roa, D. Martínez, E. Vera, C. Parra y U. Fuentes, “An Approach of the Sintering YBa2Cu3O7−δ System”. Journal of Superconductivity and Novel Magnetism, vol. 26, n° 1, pp. 2247-2251, 2013. https://doi.org/10.1007/s10948-012-1445-0
[58] D. Goldschmidt, A. Klehe, J. Schilling y Y. Eckstein, “Pressure dependence of Tc in cuprate superconductors: Application to (CaxLa1-x)(Ba1.75-xLa0.25+x)Cu3Oy.”. Physical Review B, vol. 53, n° 21, pp. 14631-14636, 1996. https://doi.org/10.1103/physrevb.53.14631
[59] J. Cepeda Grimaldos, M. Chiquillo, I. Supelano, D. Martínez, A. Sarmiento Santos y C. Parra, “Irreversibility Curve on Y1-xLuxBa2Cu3O7-δ (x=0.4, 0.5 and 0.6) superconducting”. Journal of Physics: Conference Series 480, pp. 012036, 2014. DOI: 10.1088/1742-6596/480/1/012036
[60] C. Parra, D. Landínez y J. Roa, “Determining superconducting parameters from analysis of magnetization fluctuation for CaLaBaCu3O7-d superconductor”. Physica B, vol. 398, n° 1, pp. 301-304, 2007. https://doi.org/10.1016/j.physb.2007.04.032
[61] D. Goldschmidt, A. Knizhnik, Y. Direktovitch, G. Reisner y Y. Eckstein, “Relationship between superconductor and metal-insulator transitions in a large class of tetragonal 1:2:3 cuprates Ca-R-Ba-Cu-0 (R =La, Nd)”. Physical Review B, vol. 52, n° 17, pp. 12982-12993, 1995. https://doi.org/10.1103/PhysRevB.52.12982
[62] L. Pathak y S. Mishra, “A review on the synthesis of Y–Ba–Cu-oxide powder”. Superconductor Science and Technology, vol. 18, n° 9, pp. 67–89, 2005. https://doi.org/10.1088%2F0953-2048%2F18%2F9%2Fr01
[63] R. Schwartz, “Chemical Solution Deposition of Perovskite Thin Films”. Chemistry of Materials, vol. 9, n° 11, pp. 2325-2340, 1997. https://doi.org/10.1021/cm970286f
[64] R. Munir, A. Sheikh, M. Abdelsamie, H. Hu, L. Yu, K. Zhao, T. Kim, O. Tall, R. Li, D. Smilgies y A. Amassian, “Hybrid Perovskite Thin-Film Photovoltaics: In Situ Diagnostics and Importance of the Precursor Solvate Phases”. Advanced Materials, vol. 29, n° 1, pp. 1604113, 2017. https://doi.org/10.1002/adma.201604113
[65] S. Specchia, G. Ercolino, S. Karimi, C. Italiano y A. Vita, “Solution Combustion Synthesis for Preparation of Structured Catalysts: A Mini-Review on Process Intensification for Energy Applications and Pollution Control”. International Journal of Self-Propagating High-Temperature Synthesis, vol. 26, n° pp. 166-186, 2017. https://doi.org/10.3103/S1061386217030062
[66] A. Morales, J. Gómez, C. Parra y M. Brijaldo, “Synthesis and Characterization of LaBa2Cu3O7−δ System by Combustion Technique”. Journal of Superconductivity and Novel Magnetism, vol. 29, n° 1, pp. 1163-1171, 2016. https://doi.org/10.1007/s10948-015-3311-3
[67] K. Kamata, T. Nakajima, T. Hayashi y T. Nakamura, “Nonstoichiometric behavior and phase stability of rare earth manganites at 1200°C:(1). LaMnO3”. Materials Research Bulletin, vol. 3, n° 1, pp. 49-54, 1978. https://doi.org/10.1016/0025-5408(78)90026-0
[68] V. Gupta, B. Raina, S. Verma y K. Bamzai, “Study of Structural, Spectroscopic and Dielectric Properties of Multiferroic Cadmium Doped Samarium Manganite Synthesized by Solid State Reaction Method”. AIP Conference Proceedings, vol. 1953, n° 1, pp. 050010, 1978. https://doi.org/10.1063/1.5032665
[69] S. Jin y J. Graebner, “Processing and Fabrication Techniques for Bulk High-Superconductors: A Critical Review”. Materials Science and Engineering B, vol. 7, n° 1, pp. 243-260, 1991. https://doi.org/10.1016/0921-5107(91)90001-C
[70] R. Patrick y P. Shahid, “Thermal Plasma Processing of Materials: A Review”. Advanced Performance Materials, vol. 1, pp. 35-50, 1994. https://doi.org/10.1007/BF00705312
[71] H. Zhu, Y. Lau y E. Pfender, “RF Plasma Synthesis of YBa2Cu307-x Powders”. Journal of Superconductivity, vol. 3, pp. 171-175, 1990.
[72] J. Ortiz, C. Gomez, R. Lopez, I. Davalos y H. Pfeiffer, “Syntheis of advances ceramics by hydrohermal crystallization and modified related methods”. J. Adv. Ceram., vol. 1, n° 1, pp. 204-220, 2012. https://doi.org/10.1007/s40145-012-0022-0
[73] D. Modeshia y R. Walton, “Solvothermal synthesis of perovskites and pyrochlores: Cristallisation of functional oxides under mild conditions”. Chem. Soc. Rev, vol. 39, n° 11, pp. 4303-4325, 2010. https://doi.org/10.1039/B904702F
[74] R. Zanella, “Metodologias para la sintesis de nanoparticulas: controlando forma y tamaño”. Mundo Nano. Revista Interdisciplinaria en Nanociencias y Nanotecnología, vol. 5, n° 1, pp. 69-81, 2014. https://doi.org/10.22201/ceiich.24485691e.2012.1.45167
[75] P. Kanhere y Z. Chen, “A review on visible light active perovskite-based photocatalysts”. Molecules, vol. 19, n° 12, pp. 19995-20022, 2014. https://doi.org/10.3390/molecules191219995
[76] J. Lee, J. Park y Y. Shul, “Tailoring gadolinium-doped ceria-based solid oxide fuel cells to achieve 2 W cm−2 at 550°C”. Nat. Commun., vol. 5, n° pp. 4045, 2014. https://doi.org/10.1038/ncomms5045
[77] K. Garg y G. Bowlin, “Electrospinning jets and nanofibrous structures”. Biomicrofluidics, vol. 5, n° 1, pp. 13403, 2011. https://doi.ounrg/10.1063/1.3567097
[78] R. Gopal, S. Kaur, Z. Ma, C. Chan, S. Ramakrishna y T. Matsuura, “Electrospun nanofibrous filtration membrane”. J. Membr. Sci, vol. 281, n° 1, pp. 581-586, 2006. https://doi.org/10.1016/j.memsci.2006.04.026
[79] J. Venugopal y S. Ramakrishna, “Applications of polymer nanofibers in biomedicine and biotechnology”. Appl. Biochem. Biotechnol, vol. 125, n° 3, pp. 147-157, 2005. https://doi.org/10.1385/ABAB:125:3:147.
