Rev Cuid 2014; 5(1): 595-605
ANÁLISIS DE LOS FACTORES AMBIENTALES Y OCUPACIONALES EN LA CONCENTRACIÓN DE AEROBACTERIAS EN UNIDADES DE CUIDADO INTENSIVO DEL HOSPITAL UNIVERSITARIO FERNANDO TROCONIS, 2009 SANTA MARTA-COLOMBIA
ANALYSIS OF OCCUPATIONAL AND ENVIRONMENTAL FACTORS IN THE CONCENTRATION OF AEROBACTERS IN INTENSIVE CARE UNITS OF THE FERNANDO TROCONIS UNIVERSITARY HOSPITAL, 2009 SANTA MARTA-COLOMBIA
Andrés M. Vélez-Pereira1, Yiniva Camargo Caicedo2
1Magíster en Tecnología Ambiental, Docente-Investigador, Grupo de Investigación en Modelación de Sistemas Ambientales (GIMSA). Autor de correspondencia: Dirección: Carrera 32 No. 22-08 Sector San Pedro Alejandrino. Universidad del Magdalena, Santa Marta, Colombia. Teléfono: (+57 5) 4301292 ext. 273. E-mail: avelez@unimagdalena.edu.co
2Magíster Educación Ambiental, Docente-Investigador, Líder del Grupo de Investigación en Modelación de Sistemas Ambientales (GIMSA). Santa Marta, Colombia.
Artículo recibido el 26 de Noviembre de 2013 y aceptado para su publicación el 12 de Marzo de 2014.
Cómo citar este artículo: Vélez-Pereira AM, Camargo Caicedo Y. Análisis de los factores ambientales y ocupacionales en la concentración de aerobacterias en unidades de cuidado intensivo del Hospital Universitario Fernando Troconis, 2009 Santa Marta-Colombia. Rev Cuid. 2014; 5(1): 595-605.
RESUMEN
Introducción: La evaluación de la calidad biológica del aire de ambientes hospitalarios resulta de especial interés debido a que los pacientes puedan servir como una fuente de bacterias patógenas para el personal del hospital, los visitantes y otros pacientes, siendo relevante en unidades de asistencia especializadas en atención de patologías crónicas como cáncer, SIDA y pacientes con trasplante de órganos o con complicaciones severas en su estado de salud, y que requieren una intervención masiva para su tratamiento en salas de cirugía y/o unidades de cuidado intensivo. Evaluar la influencia de factores ambientales y de ocupación de la unidad en la concentración de aerobacterias de unidades de cuidado intensivo del Hospital Universitario Fernando Troconis. Materiales y Métodos: Se colectaron muestras triplicadas con agar selectivo para Staphylococcus spp. y Pseudomonas spp., en dos estaciones de cada una de las tres UCI, mediante impactador de 2 etapas ubicado a altura de1.5m y caudal constante (28.3l/min) durante 5min, incubándolas a 37°C por 48h. Los factores ambientales se registraron con anemómetro Kestrel 4500 y ocupación de la unidad mediante registro manual del número de pacientes y personal asistencial de la unidad. Resultados: La máxima concentración fue 979.9±31.3UFC/m3 y el máximo promedio, 315.6±59.7UFC/m3. Staphylococcus spp. Superaron la concentración de Pseudomonas spp. La máxima ocupación fue en UCI Adulto, mayor temperatura en UCI Pediátrica y humedad más baja en UCI Adulto. Discusión y Conclusiones: La concentración de aerobacterias superó valores reportados por estudios aerobiológicos hospitalarios, y presenta relaciones leves con temperatura y escasa o nula con ocupación de la unidad.
Palabras clave: Partículas Viables en el Aire, Ambiente, Infección Hospitalaria, Ocupación de Camas, Cuidados Intensivos, Viabilidad Microbiana. (Fuente: DeCS BIREME).
ABSTRACT
Introduction: Assessing of biological quality of air in hospital environments is of particular interest because patients can be a source of pathogenic bacteria for hospital staff, visitors and other patients. It is relevant in specialized care of chronic diseases like cancer, AIDS and organ transplant patients or severe health complications, which require massive intervention for treatment in the operating room and/or intensive care units. To evaluate the influence of environmental factors and intensive care unit occupancy in the concentration of aerobacteria in intensive care units of Fernando Troconis Universitary Hospital. Materials and Methods: Triplicate samples were collected with selective agar for Staphylococcus spp. and Pseudomonas spp. using two-stage cascade impactor located 1.5 m high and constant flow (28.3l/min) for five minutes, locating two stations in each of the three ICU; the collected samples were incubated at 37°C for 48 hours. Environmental factors were recorded with anemometer Kestrel 4500 and occupancy of the unit by manually recording the number of patients and health care personnel of the unit. Results: Maximum concentration was 979.9±31.3CFU/m3 and maximum average 315.6±59.7CFU/m3. Staphylococcus spp. exceeded the concentration of Pseudomonas spp. Maximum intensive care unit occupancy was in adult ICU, higher temperature in pediatric ICU and lower humidity in adult ICU. Discussion and Conclusions: Aerobacteria concentration exceeded values reported by other aerobiological studies in hospital also has little relationship with temperature and little or no with intensive care unit occupancy.
Key words: Airborne Particles, Environment, Cross Infection, Bed Occupancy, Intensive Care, Microbial Viability. (Source: DeCS BIREME).
INTRODUCCIÓN
Las infecciones nosocomiales son un problema de interés para las instituciones sanitarias debido a las implicaciones asociadas, económicas, sociales y humanas, con el aumento de la morbi-mortalidad, hospitalización prolongada y aumento de los costos asociados. En el caso de las UCI, los estudios de este tipo permiten, de manera conjunta con la sintomatología del paciente, identificar el posible agente causante de la infección nosocomial con un mayor grado de precisión, lo que agiliza la aplicación de un adecuado tratamiento que reduzca el tiempo de hospitalización y la resistencia, así como el aumento de las probabilidades de mejoría del paciente en respuesta al antibiótico aplicado (1).
A escala mundial las IN, consideradas un importante problema y un motivo de preocupación en las instituciones del sector salud por las implicaciones económicas, sociales y humanas que establecen con la adquisición de enfermedades, se relacionan con microorganismos multi-resistentes presenten en superficies, instrumentos e incluso en aire ambiente de los centros hospitalarios. Esta situación dificulta la aplicación de tratamiento efectivo para contrarrestar los efectos de los microorganismos, traduciéndose en mayores tiempos y costos de hospitalización, en comparación con las infecciones causadas por cepas sensibles (2-3).
Actualmente, muchas investigaciones se han enfocado en establecer las rutas probables y frecuentes entre la fuente portadora del microorganismo y el paciente, (4-5), así como el riesgo asociado (6-8), además de realizar análisis estadísticos retrospectivos de las infecciones desarrolladas y parámetros médicos (edad, sexo, patología entre otras) (9-10), análisis de multiresistividad a los antibióticos (6,11-14), o simplemente, algunas investigaciones a nivel internacional (15-22), han enfocado sus investigaciones, en el estudio de las aerobacterias presentes en las unidades de centros de asistencia médica; sin embargo, no se precisan los factores físicos que favorecen la presencia de estos microorganismos en las unidades.
Las aerobacterias están expuestas a distintos tipos de estrés ambiental que dan lugar a su inactivación, siendo los factores que más influencia tienen en la viabilidad de los microorganismos el contenido de agua en la atmósfera, temperatura, y radiación UV, entre otros factores característicos de ambientes al aire libre (23-24). No obstante, en centros hospitalarios la humedad relativa y temperatura son controladas artificialmente, lo que constituyen como factores ambientales de mayor relevancia, puesto que favorecen la viabilidad al tiempo que afectan la aerodinámica de los microorganismos, aumentando la probabilidad de resuspensión y transporte en condiciones de estrés mínimo (25).
En consecuencia, la evaluación de la calidad biológica del aire de ambientes hospitalarios resulta de especial interés, entendida la calidad biológica como la ausencia de aerosoles biológicos en la unidad; no obstante, en los ambientes hospitalarios, los pacientes, el personal asistencia, equipos médicos e incluso los sistemas de ventilación de la unidad, entre otros puedan servir como una fuente de bacterias patógenas para el personal del hospital, los visitantes y otros pacientes, siendo relevante en unidades de asistencia especializadas en atención de patologías crónicas como cáncer, SIDA y pacientes con trasplante de órganos o con complicaciones severas en su estado de salud, que requieren una intervención masiva para su tratamiento en salas de cirugía y/o unidades de cuidado intensivo (UCI).
Los microorganismos más frecuentes en el desarrollo de infecciones nosocomiales son Pseudomonas spp. y Staphylococcus spp.; estudiándose Pseudomonas aeruginosa y Staphylococcus aereus como las especies más representativas de cada género, respectivamente (26-27), asociado como agentes patógenos de un alto número de casos de IN en las UCI de diversos centros de salud. Para el caso puntual de las UCI del Hospital Universitario Fernando Troconis (HUFT) se reportan en los cultivos biológicos obtenidos de pacientes ingresados a las diferentes unidades, que 39% corresponden a Staphylococcus aereus, seguido por Staphylococcus xylosus con 20%, Staphylococcus lentus con 14% y 23% de especies sin identificar. Mientras que para el caso de los Gram negativos, Pseudomona aeruginosa reporta 11% y Pseudomona luteola con 8%; dado el escaso control del sistema de vigilancia epidemiológica; no se precisa mayor información por lo que se evidencia la necesidad de evaluar la concentración de estos organismos en el aire (28).
En este sentido, el presente trabajo busca analizar la influencia de los factores ambientales y de la ocupación de unidades sobre los niveles de concentración de aerobacterias (Staphylococcus spp. y Pseudomonas spp.) presente en el aire ambiente de las UCI del Hospital Universitario Fernando Troconis (HUFT).
MATERIALES Y MÉTODOS
Descripción del área de estudio
El área de estudio corresponde a las UCI del HUFT ubicado en el Distrito de Santa Marta, Colombia. Las instalaciones de este hospital tienen tres UCI clasificadas de acuerdo con la edad del paciente: i) UCIAdulto (UCIA) atiende al personal joven y adulto comprendida por pacientes mayores de 15 años; ésta es la unidad con más camas de atención para pacientes (19 camas); ii) UCIPediátrica (UCIP) destinada a la atención de niños comprendidos en un rango de edad entre 31 días de nacido y 14 años, y es la UCI más pequeña y con menor cantidad de camas para pacientes (7 camas); y iii) UCINeonatal (UCIN) se especializan en el cuidado de neonatos comprendidos entre los 0 y 31 días de nacido (dispone de 14 camas de atención para pacientes).
Diseño del muestreo
Muestreo de aerobacterias
En cada UCI se localizaron dos estaciones de monitoreo (estación 1: S1 cercana al puesto de enfermería y entrada de la unidad, y estación 2: S2 ubicada en el centro de la segunda mitad de la UCI), ubicadas en el eje central de la unidad de forma equidistante del eje transversal, y en puntos aislados de la influencia de corrientes de aire del sistema de ventilación artificial de la unidad, así como de posibles fuentes o focos emisores de aerobacterias. La recolección de aerobacterias se realizó mediante un impactador de cascada integrado de dos (2), etapas, para partículas viables Serie 10-800 marca Tisch Environmental Inc., ubicado a una altura de 1.5 metros sobre el nivel del suelo (altura proporcionada por un trípode), operando a un caudal constante de 28.3 l/min, verificado mediante un manómetro de presión diferencial Capsuhelic marca Dwyer serie RM, que es acoplado al sistema.
La toma de la muestra se efectuó durante cuatro (4), campañas de muestreo iniciando en diciembre del 2009 y culminando en marzo 2010 con una lectura mensual. En cada campaña de monitoreo se realizaron tres ensayos para cada estación en las tres UCI, colocando simultáneamente en las dos etapas del impactador de cascada, cajas Petri con agar manitol salado para la recolección de aerobacterias Staphylococcus spp. y agar Pseudomonas con suplemento CFC para la recolección de aerobacterias Pseudomonas spp., obteniendo así seis (6), cajas por cada estación/muestreo-medio, doce (12), muestras por unidad/muestreo-medio, 36 cajas/muestreo-medio. En total, durante el desarrollo de las campañas de muestreo se recolectaron 288 muestras.
El tiempo de colecta fue obtenido a partir de revisión de la literatura y ajustado con los resultados de una campaña de premuestreo, ensayando colectas a 2, 5 y 10 min, estableciendo un tiempo óptimo de colecta de cinco (5), minutos, justificado en criterio estadístico de límites de detección de concentración (máximos y mínimos) y precisión de resultados.
Medición de temperatura y humedad relativa
Para la medición de los factores ambientales (FA), temperatura y humedad relativa en UCI del HUFT, se empleó un anemómetro marca Kestrel serie 4500 previamente calibrado y certificado, la lectura de las variables se realizó en periodos de tiempo de 10 minutos y en el eje central de la unidad, evitando el paso de corrientes de aire provenientes del sistema de ventilación artificial.
Registro de ocupación de la unidad (OU)
El registro de OU se realizó empleando un formato de registro aplicado en dos momentos: al inicio y finalización de la toma de muestra en cada UCI, registrando de manera puntual el número de pacientes presentes en la unidad y el número de personal asistencial, para establecer el promedio del personal que ocupó la unidad. Es importante mencionar que el registro sólo contempla el promedio de personal de mayor permanencia en la UCI, realizando los muestreos en horario inmediatamente anterior a la visita, rondas médicas, supeditado a las recomendaciones del personal del hospital.
Aseguramiento y control de calidad de las muestras
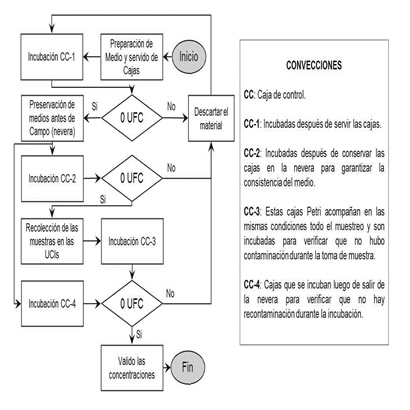
Para garantizar la calidad de las muestras se aplicó el protocolo de aseguramiento y control que se resume en la Figura 1, consistente en la preparación de cajas adicionales que se incuban al final de cada fase del proceso para verificar la ausencia de crecimiento de microorganismos. Adicionalmente se aplicaron otras medidas para el aseguramiento y control de calidad, mediante la envoltura de cajas Petri en película plástica para evitar la exposición a contaminantes externos, y el posterior sello de las cajas colectadas con cinta parafinada, para permitir que los microorganismos respiren, pero impedir el ingreso de partículas y/o microorganismos que contaminen la muestra. Otra medida complementaria consistió en la esterilización del impactador de cascada entre cambio de cada caja Petri, mediante la combinación de desinfección con alcohol y por choque térmico (flameo).
Figura 1 . Esquema del protocolo de aseguramiento y control de calidad de las muestras

Fuente: Elaboración de los autores
Análisis de las muestras
Posterior a la recolección de las muestras en cada estación de monitoreo, se realizó la incubación a 37ºC durante 48 horas; luego de este periodo se efectúo el recuento de aerobacterias por caja Petri utilizando el contador de colonia marca LEICA. Las cepas colectadas en los medios eran verificadas mediante la aplicación de pruebas rápidas de coagulasa para Staphylococcus spp. y Oxidasa para Pseudomonas spp.
Los datos obtenidos en el laboratorio se ingresaron a una hoja de cálculo, en la que se realizaron las operaciones para determinar la concentración de aerobacterias por género estudiado en función de la unidad, estación, etapa y réplica utilizando la siguiente expresión matemática:

Donde el volumen de aire se calcula como el producto entre el caudal de bombeo y el tiempo de muestreo, reportándose un volumen de 141.5 litros.
Análisis de los resultados
Las concentraciones reportadas en cada réplica se promediaron aritméticamente por etapas, y el resultado de la suma del promedio arrojó la concentración por campaña de monitoreo. Los resultados fueron analizados en función de la concentración, empleando como variables de posible incidencia en la respuesta: UCI y estación; por tanto, el análisis estadístico realizado se ajusta a un análisis de varianza jerarquizado.
El establecimiento de la influencia de la temperatura, la humedad relativa y ocupación de UCI sobre la concentración de aerobacterias se realizó con un análisis de Correlación Ordinal de Spearman, midiendo la fuerza de la asociación entre las variables en un rango de +1 a -1, donde entre más cercano esté a uno indica una mayor relación mientras que el signo indica el tipo de relación: directa (+) o indirecta (-).
RESULTADOS
Concentración de aerobacterias
En el Tabla 1 se observan las concentraciones registradas para aerobacterias en función de UCI estación de monitoreo y género. Los resultados obtenidos demuestran que la unidad de cuidado intensivo con mayor concentración promedio corresponde a UCIA, seguida de UCIN y finalizando con UCIP. En cuanto al análisis de las concentraciones máximas reportadas por género, a partir de los valores promedio en las estaciones S1 y S2 de cada unidad, se registra UCIA con la mayor concentración de Staphylococcus spp. (607.7 UFC/m3), seguida por UCIP (213.9 UFC/m3) y terminando con UCIN (147.7 UFC/m3).
Tabla 1. Cuantificación de aerobacterias en UCI del Hospital Universitario Fernando Troconis
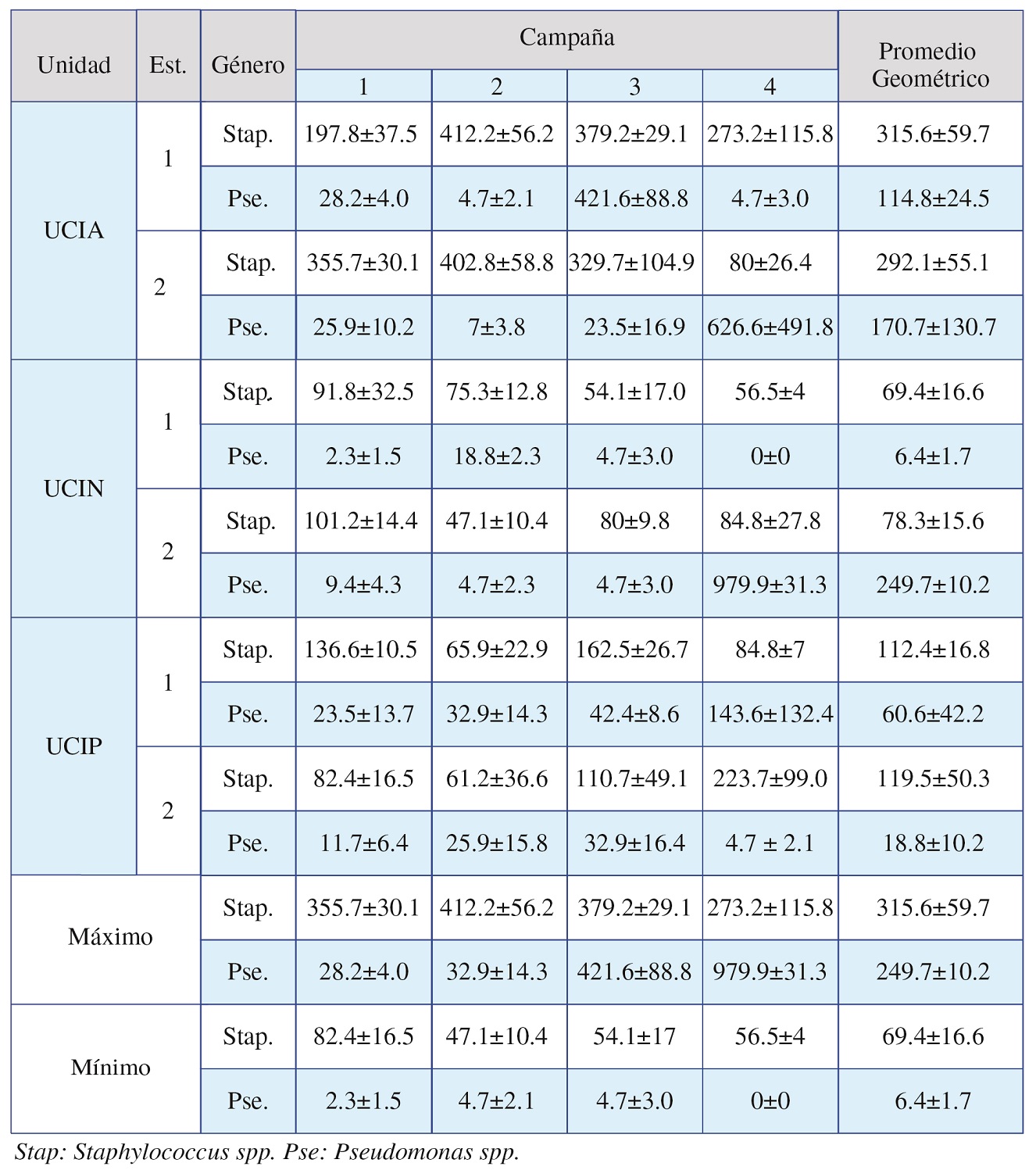
Fuente: Base de datos del estudio.
En el caso de Pseudomonas spp. A partir de la suma de los promedios de S1 y S2 en las respectivas unidades, UCIA es la que reporta los mayores promedio (285.5 UFC/m3), seguida por la UCIN (256.1 UFC/m3) y terminando con UCIP (79.4 UFC/m3). El orden decreciente de la concentración en función del género bacteriano es consistente con lo establecido de forma general, reportándose para ambas situaciones UCIA como la unidad con mayores valores de concentración.
En general la máxima concentración de aerobacterias reportadas en las campañas, se registró con un valor de 979.9±31.3 UFC/m3 en S2 de UCIN. Mientras que al analizar las concentraciones máximas obtenidas en función del microorganismo colectado, se puede establecer que la concentración máxima de Staphylococcus spp. se presenta en S1 de UCIA (412.25±56.2 UFC/m3), mientras que para Pseudomonas spp. la máxima concentración se reporta en S2 de UCIN (979.9±31.3 UFC/m3).
En general, se puede observar que la predominancia de Staphylococcus spp. en este estudio representa 69.64% del total de muestras colectadas, evidenciando la predominancia de este género en la 1ra y 2da campañas de muestreo con porcentajes superiores al 90%. Ahora, si se analizan las concentraciones obtenidas por estación de muestreo en cada unidad se observa que para el caso de UCIA, 52.8% lo representa S2, 59.5% en S1 de UCIP, mientras que en S2 de UCIN se registró la mayor concentración con 80.2% del total de aerobacterias colectadas.
En cuanto a FA y OU, los resultados se resumen en el Tabla 2 mediante las medias y su desviación estándar, identificando que UCIP es la que presenta mayores niveles de temperatura y humedad relativa, seguida por UCIN y UCIA respectivamente, mientras que la mayor ocupación se presenta en orden inverso, siendo UCIA la de mayor ocupación, seguidas de UCIN y UCIP.
Tabla 2. Factores ambientales y ocupación en las UCI del Hospital Universitario Fernando Troconis
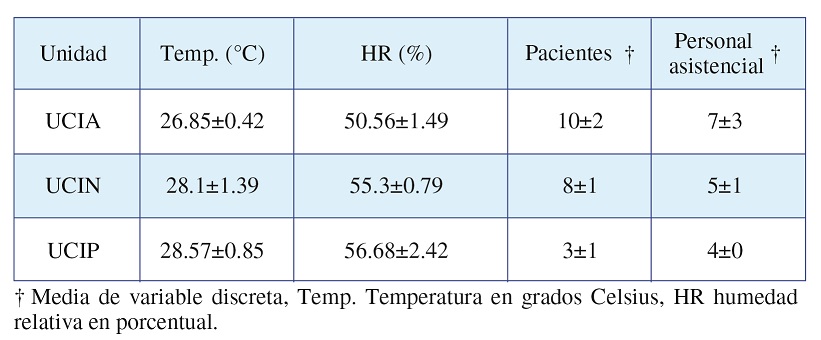
Fuente: Base de datos del estudio.
Análisis Estadístico
Análisis de varianza de la concentración
Figura 2. Análisis de varianza jerarquizados de la concentración de aerobacterias en UCI del HUFT
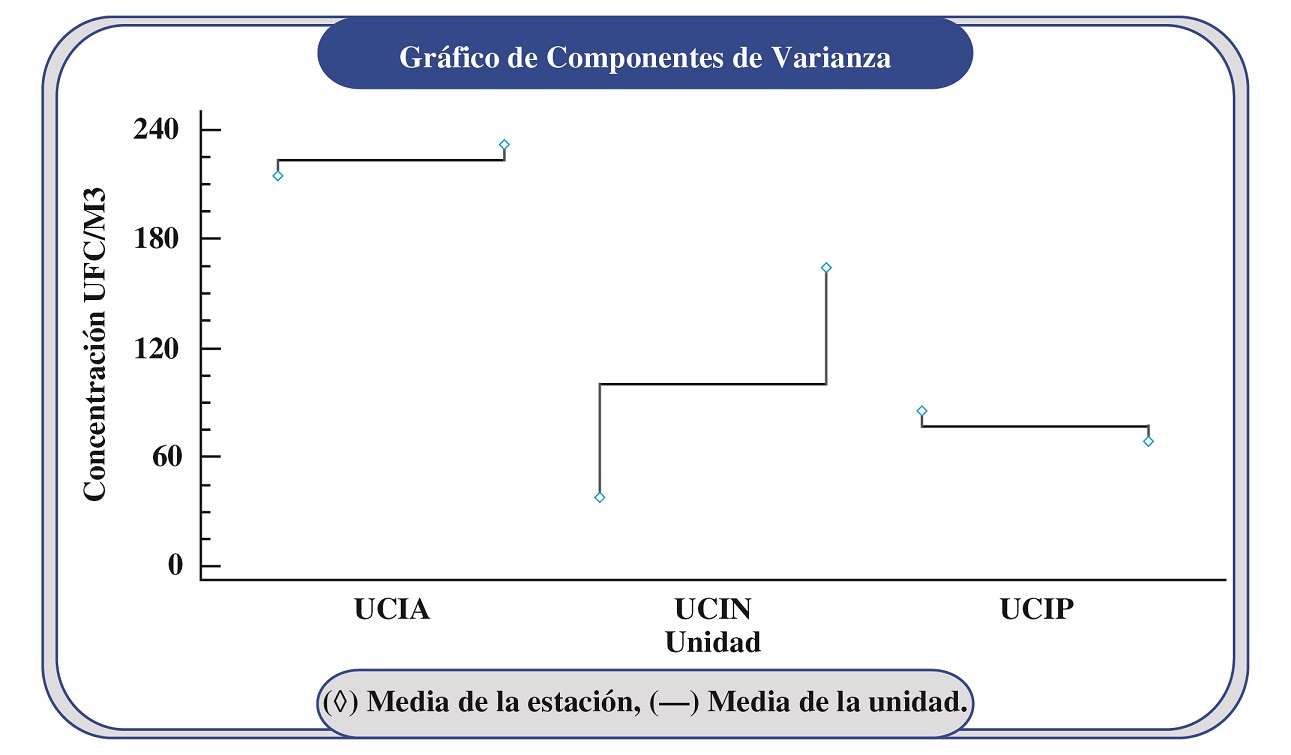
Fuente: Base de datos del estudio.
Los resultados del análisis estadístico ANOVA reflejaron que no existe una diferencia significativa entre una media de la UCI y otra, evidenciada por la conformación de un grupo homogéneo entre la UCIP y UCIN (Figura 2), y es ratificado por el P-valor obtenido para las medias de las UCI (0.0651), que es mayor que el P-valor critico (0.05) establecido con un nivel de confianza del 95%. Esta misma situación se evidencia en las estaciones de cada UCI, donde la estación dentro de cada unidad no afecta la concentración de aerobacterias; soportado por P-valor observado (0.4356) es mayor al P-valor crítico (0.05) con una confianza del 95%. Finalmente, si se analiza la influencia del género bacteriano sobre la varianza de la concentración reportada, el P-valor observado (0.2547) mayor que P-valor critico ratifica que no establece ningún efecto significativo.
Relación entre los factores ambientales y ocupación de la unidad con la concentración de aerobacterias.
En el Tabla 3 se observan los coeficientes de correlación y las concentraciones de Staphyloccocus spp. con relaciones mayores con FA y OU que las aerobacterias Pseudomonas spp., así mismo se puede inferir que FA presenta menor correlación de OU; no obstante, si se detalla la relación entre FA y las concentraciones, se puede observar que la temperatura se encuentra más fuertemente ligada con la concentración que con la humedad relativa; si este mismo análisis se realiza para OU se puede inferir que la ocupación por paciente reporta una relación mayor que la ocupación por personal médico con la concentración de aerobacterias en UCI.
En cuanto a la relación de cada unidad con FA y OU, se observa que UCIA es la de mayor correlación seguida por UCIP con similar correlación, mientras que UCIN presenta la más baja. Ahora particularmente sólo la temperatura y la ocupación por pacientes tienen una relación en UCIA, con una correlación directa con la concentración de aerobacterias Staphylococcus spp. con un nivel de significancia del 95%, mientras que UCIP mantiene una correlación con la humedad, en cuanto a la incidencia de Staphylococcus spp. Es preciso mencionar que el método de captura de aerobacterias empleado para este estudio es un método activo, que puede tener una influencia mayor en la viabilidad de los microorganismos al ser estresados en la impactación y posterior incubación, que no puede ser establecida en el método estadístico.
Tabla 3. Correlación Ordinal de Spearman entre Factores Ambientales, Ocupación de la Unidad y las concentraciones de aerobacterias en UCI del HUFT

Fuente: Base de datos del estudio.
Los valores entre paréntesis corresponden a los P-Valor observados en cada correlación, si este es menor al P-Critico (0.05) se considera que hay una relación estadísticamente significativa con un nivel de confianza del 95%. *No se realiza el análisis por ser datos homogéneos. T Temperatura en grados Celsius, HR humedad relativa en porcentual
DISCUSIÓN
Concentración de aerobacterias
Los estudios detallados de aerobacterias en ambientes hospitalarios son escasos en la literatura, no obstante Golbabaee et al. (2013) reportaron concentraciones que van desde 294.47 a 1226.88 UFC/m3 en el hospital de Teherán en Irán (15). Así mismo, se registran concentraciones de aerobacterias en hospitales entre 10 y 1000 UFC/m3 (14,15), reportándose los valores promedios de las tres unidades entre el límite inferior de los valores aquí registrados, encontrándose promedios de Pseudomonas spp. Cercanos al límite inferior, mientras la concentración de Staphylococcus spp. Se ubica próximo al primer cuarto de los valores del rango.
Obbard y Fang establecieron que la concentración en las salas de hospitales fluctúa entre 42 y 325 UFC/m3 (16); comparando este rango con el presente estudio se puede establecer que los promedios no superan lo reportado, cercano al límite superior; sin embargo, los valores máximos reportados superan notoriamente el valor máximo del rango. Si se analizan los valores de aerobacterias registrados en función del género, se puede identificar que Staphylococcus spp. Tiende al límite superior exceptuando UCIN, que tiende al límite inferior. El promedio de Pseudomonas spp. En UCIA reporta valores ubicados en el eje central de rango, mientras que para UCIN y UCIP se identifica que los valores se ubican cercanos al eje central del rango, discrepando solamente UCIN, que igual que en el caso anterior tiende al límite inferior. Consecuentemente, como se ha venido estableciendo la comparación, los valores máximos reportados a lo largo de las campañas de muestreo superan el rango establecido, aunque para Pseudomonas spp. Sólo se presentan dos eventos, mientras que para Staphylococcus spp. Se presenta en todas las campañas.
En síntesis, los niveles de aerobacterias reportadas superan las medias presentadas por Hoseinzadeh et al. 2013 en estudios realizados en 5 hospitales universitarios en Hamedan en Irán (16), mientras que los resultados se encuentran cercanos a las medias reportadas por Den et al. (2013) en el estudio realizado en dos unidades de cuidado intensivo en Taiwan. Entre tanto para Europa los niveles de bacterias en el aire se reportan entre 10 y 100 UFC/m3, datos similares a los presentados por Brenniman y Allen para un hospital en Illinois-EE.UU (14).
Si bien es cierto que el análisis realizado manifiesta concordancia en los resultados, se puede realizar un análisis más puntual para UCIP y UCIN, con base en el estudio desarrollado por Li y Hou, reportando una máxima concentración de 156 UFC/m3 y una media aproximada de 82.16 UFC/m3 para la UCIP (14). En general, los promedios de Staphylococcus spp. Superan los valores establecidos, mientras que los valores medios de Pseudomonas spp. Se reportan por debajo del nivel establecido; sin embargo, esta situación se repite si analizamos los valores máximos reportados para esta unidad con el reportado por el estudio, puesto que Staphylococcus spp. (223.7±99.0UFC/m3) supera el valor, mientras que Pseudomonas spp.(143.6±132.4UFC/m3) no lo superan, ajustándose al nivel.
De igual forma que en el caso anterior, se reportan valores de concentración de aerobacterias en UCIN, con un valor máximo de 129 UFC/m3 y una media de 53.2 UFC/m3 (14), donde el promedio de Staphylococcus spp. Al igual que en UCIP supera el valor referente, sin que la diferencia entre el valor referente y el obtenido sea tan amplia como la obtenida en UCIP; en cuanto a la concentración de Pseudomonas spp. Los valores medios reportados por este estudio, sólo se ajustan al igual que en el caso de S1 UCIP, en contraposición de la S2 que supera por una amplia diferencia el valor establecido por la investigación. En lo referente a los valores máximos se evidencia una superación por parte de ambos géneros estudiados de los niveles establecidos, evidenciando una mayor diferencia para el caso de Pseudomonas spp.
Una de las primeras directrices con respecto a la concentración de aerobacterias se propuso en 1946, sugiriendo no más de 0.1-20 UFC/m3 que deberían crecer en 24 h en los quirófanos (29). The American Conference of Governmental Industrial Hygienists (ACGIH) sugirió normas provisionales de exposición basadas en los niveles cultivables de bacterias y hongos que recomiendan menos de 100 UFC/m3 como nivel aceptable (30), pero estas directrices han sido derogadas desde 1999 (31).
Sin embargo, la mayoría de estas directrices se basan en la concentración de aerosoles biológicos, sin tener en cuenta los efectos sobre la salud humana (32). Además, la mayoría de estudios han propuesto umbrales de concentración de aerosoles biológicos basados en la recolección de microorganismos sobre cultivos enriquecidos con agar (33-34). No obstante organizaciones como la Organización del Tratado del Atlántico Norte (OTAN) y la Organización Mundial de la Salud (WHO, por sus siglas en inglés) han coincidido en que existe una necesidad de desarrollar métodos más precisos y robustos para la caracterización de aerosoles biológicos (35-36). Dado que muchas enfermedades asociadas a los aerosoles biológicos no dependen de la infección para inducir efectos adversos sobre la salud, es importante cuantificar todas las células microbianas que están suspendidas en el aire, así como diferenciar entre áquellas que son metabólicamente activas, las que son cultivables y las que no son viables (37).
Relación entre factores ambientales y ocupación de la unidad con la concentración de aerobacterias
Los resultados obtenidos en cuanto a la relación de factores ambientales y la concentración de aerobacterias es consistente por la presentada por Abdel et al. (2007) y Abdel (2005), reportando una relación directa entre la temperatura en la mitad de los datos, y una inversa con la mayoría de los valores reportados para la humedad relativa (38-39), no obstante es imperante mencionar que las correlaciones establecidas por el autor se realizan en ambientes outdoor y bajo métodos pasivos de recolección, este último aspecto puede generar un aumento considerable en los valores obtenidos de correlación.
En cuanto a la influencia de la temperatura sobre la concentración de aerobacterias determinada en el estudio, es consistente con la literatura, en la que se afirma que un aumento en la temperatura puede influir rápidamente en la viabilidad del microorganismo (24), generando como consecuencia la deshidratación del microorganismo; no obstante las condiciones secas de un ambiente con altas temperaturas permiten a su vez una mayor diseminación de aerosoles. Esto es consecuente con las concentraciones reportadas, puesto que UCIA es la que presenta menor temperatura promedio y mayores concentraciones de aerobacterias, mientras UCIP presenta mayores temperaturas y menores concentraciones. Para el caso de la humedad relativa, se considera como uno de los factores cruciales en la viabilidad de los aerosoles biológicos (23-24, 40-41). Algunos autores afirman que un aumento de esta variable puede ser empleado por los aerosoles biológicos como protección a los procesos de desecación e inactivación por la radiación UV presente en los ambientes outdoor (42); sin embargo, para el caso puntual de este estudio y dada la ausencia de radiación UV, la humedad relativa actúa como un agente controlador, puesto que permite una condensación de la humedad en el aerosol permitiendo una deposición húmeda del aerosol principalmente asociado al aumento de la adhesión de su membrana (43).
Por último, es preciso aclarar que la temperatura y la humedad relativa están en una estrecha relación, por lo que es difícil separar los efectos que producen ambas sobre la viabilidad de los aerosoles biológicos, ya que se ha demostrado que con un aumento de la temperatura a condiciones estables de humedad relativa se presenta una disminución en la viabilidad de los microorganismos.
CONCLUSIONES
La concentración de aerobacterias supera los valores presentados por otros estudios aerobiológicos en hospitales. Las mayores concentraciones se reportan en UCIA, seguidas de UCIP y UCIN que presentan valores muy similares, en cuando a los resultados obtenidos en función del género, por lo que se puede concluir que Staphylococcus spp. Representa el mayor porcentaje del total colectado. Por último la relación de FA con la concentración de aerobacterias reporta una influencia débil entre la temperatura y las aerobacterias, y nula con la humedad relativa. Mientras que para OU no se asocia de una forma clara con las concentraciones reportadas en UCI.
Agradecimientos
Los autores expresan sus agradecimientos a Ayudas a la investigación de Fundación MAPFRE y a Universidad del Magdalena por la financiación de este proyecto, al Ingeniero Tomás Bolaño Ortiz por su gestión administrativa, a los auxiliares de investigación Sandra Rocío Balaguera Rincones y Antonio Álvarez Mancilla, por su esfuerzo permanente y dedicación.
Declaración de conflicto de intereses: Los autores declaran que no tienen conflicto de intereses.
REFERENCIAS BIBLIOGRÁFICAS