Rev Cuid. 2024; 15(3): e3861
Resumen
Introducción: La disfagia orofaríngea neurogénica es una forma de disfagia funcional causada habitualmente por enfermedades neurológicas y neuromusculares, que produce varias complicaciones secundarias. En pro de mejorar su detección y caracterización surgen modelos que integren variables clínicas para complementar el examen físico de la deglución. Objetivo: Desarrollar un modelo explicativo para diferenciar pacientes con disfagia orofaríngea neurogénica. Materiales y Métodos: Estudio de casos y controles basado en un conjunto de datos derivados del examen clínico de la deglución con énfasis neurológico realizado en una muestra de pacientes con disfagia orofaríngea neurogénica de causas neurológicas y neuromusculares (casos), y en personas sanas (controles). Resultados: Se compararon 158 variables clínicas entre ambos grupos, donde se identificaron aquellas con mayor capacidad de clasificación, integradas en un modelo explicativo de regresión logística binaria conformada por nueve variables: dos antecedentes, dos síntomas, tres signos de examen físico y dos signos tras prueba de consistencia/volumen con alimentos. La variable dependiente fue la categoría de ser sano o paciente y las covariables fueron las variables clínicas. Parámetros que alcanzó el modelo: criterio de información de Akaike 102 y R2 de Nagelkerke 0,78. Discusión: Las nueve variables que ingresaron al modelo, en conjunto, logran explicar en gran medida la presencia de disfagia orofaríngea neurogénica, y son accesibles por examen físico de la deglución. Conclusiones: El modelo obtenido puede mejorar y/o complementar el proceso evaluativo que se realiza en pacientes con disfagia de causas funcionales, enfermedades neurológicas y neuromusculares, en procesos de tamizaje y caracterización diagnóstica.
Palabras Clave: Deglución; Trastornos de Deglución; Enfermedades del Sistema Nervioso Central; Enfermedades Neuromusculares; Signos y Síntomas; Estudios de Casos y Controles.
Abstract
Introduction: Neurogenic oropharyngeal dysphagia is a form of functional dysphagia usually caused by neurological and neuromuscular diseases, which produces several secondary complications. To improve its detection and characterization, models are emerging that integrate clinical variables to complement the physical examination of swallowing. Objective: Develop an explanatory model to differentiate patients with neurogenic oropharyngeal dysphagia. Materials and Methods: Case-control study based on a set of data derived from the clinical examination of swallowing with neurological emphasis carried out in a sample of patients with neurogenic oropharyngeal dysphagia of neurological and neuromuscular causes (cases), and in healthy people (controls). Results: 158 clinical variables were compared between both groups, where those with the greatest classification capacity were identified, integrated into an explanatory binary logistic regression model made up of nine variables: two history, two symptoms, three physical examination signs and two signs after consistency/volume test with food. The dependent variable was the category of being healthy or patient and the covariates were the clinical variables. Parameters reached by the model: Akaike information criterion 102 and Nagelkerke R2 0.78. Discussion: The nine variables that entered the model, together, largely explain the presence of neurogenic oropharyngeal dysphagia, and are accessible by physical examination of swallowing. Conclusions: The model obtained can improve and/or complement the evaluation process carried out in patients with dysphagia of functional causes, neurological and neuromuscular diseases, in screening and diagnostic characterization processes.
Keywords: Deglutition; Deglutition Disorders; Central Nervous System Diseases; Neuromuscular Diseases; Signs and Symptoms; Case-Control Studies.
Resumo
Introdução: A disfagia orofaríngea neurogênica é uma forma de disfagia funcional geralmente causada por doenças neurológicas e neuromusculares, que produz diversas complicações secundárias. Com o objetivo de melhorar a sua detecção e caracterização, estão surgindo modelos que integram variáveis clínicas para complementar o exame físico da deglutição. Objetivo: Desenvolver um modelo explicativo para diferenciar pacientes com disfagia orofaríngea neurogênica. Materiais e Métodos: Estudo caso-controle baseado em um conjunto de dados derivados do exame clínico da deglutição com ênfase neurológica realizado em uma amostra de pacientes com disfagia orofaríngea neurogênica de causas neurológicas e neuromusculares (casos) e em pessoas saudáveis (controles). Resultados: Foram comparadas 158 variáveis clínicas entre os dois grupos, onde foram identificadas aquelas com maior capacidade de classificação, integradas em um modelo explicativo de regressão logística binária composto por nove variáveis: dois antecedentes, dois sintomas, três sinais de exame físico e dois sinais após consistência /volume teste com alimentos. A variável dependente foi a categoria de ser saudável ou paciente e as covariáveis foram as variáveis clínicas. Parâmetros alcançados pelo modelo: critério de informação de Akaike 102 e Nagelkerke R2 0,78. Discussão: As nove variáveis que entraram no modelo, juntas, explicam em grande parte a presença de disfagia orofaríngea neurogênica, e são acessíveis pelo exame físico da deglutição. Conclusões: O modelo obtido pode melhorar e/ou complementar o processo de avaliação realizado em pacientes com disfagia de causas funcionais, doenças neurológicas e neuromusculares, em processos de triagem e caracterização diagnóstica.
Palavras-Chave: Deglutição; Transtornos de Deglutição; Doenças do Sistema Nervoso Central; Doenças Neuromusculares; Sinais e Sintomas; Estudos de Casos e Controles.
Introducción
La disfagia es una alteración del tránsito de los alimentos y líquidos desde la cavidad oral a hipo faringe y esófago. La gran variedad de estructuras involucradas en el proceso de tragar sugiere que diferentes mecanismos fisiopatológicos pueden resultar en disfagia, dependiendo de la enfermedad subyacente, el deterioro estructural y funcional asociado1.
Su prevalencia en población general se encuentra entre el 8,4% al 16%2. Es más prevalente en adultos mayores donde el proceso de envejecimiento aumenta la probabilidad de adquirir comorbilidades neurológicas, respiratorias, cardiovasculares y gastrointestinales, y estas a su vez pueden generar disfagia3.
La disfagia como síntoma es una sensación de adherencia y obstrucción del paso de los alimentos a través de boca, faringe o esófago, secundario a una dificultad en movilizar el bolo alimenticio de manera segura de la cavidad oral al estómago, sin que aparezca una aspiración4,5. Pero la disfagia no siempre es evidente o sintomática, y puede presentarse sutilmente como pérdida de peso, notable aumento en el tiempo necesario para comer, movimientos laterales o de inclinación de la cabeza al comer, repetida necesidad de tomar agua con los alimentos, hasta la presencia de infecciones respiratorias a repetición6,7. En ciertos casos es solo una de varias manifestaciones de una enfermedad sistémica, pero desde una visión clínica y epidemiológica es más probable que posea una etiología neurológica8,9. Por localización anatómica y clínica se clasifica en disfagia orofaríngea (DO) y esofágica, y por su etiología en causas estructurales (mecánicas), motoras (de propulsión) y funcionales10,11.
La DO, conocida también como disfagia de transferencia, se caracteriza por la dificultad en iniciar la deglución, más problemas para mover el bolo alimenticio por compromiso de la fase oral, preparatoria oral o faríngea de la deglución11. Fuera de ser una forma clínica de disfagia es un trastorno acompañante de varias enfermedades, especialmente neurológicas y neuromusculares, tanto en niños como en adultos. Un aspecto clave es que es heterogénea y compleja1, y está frecuentemente asociada con complicaciones secundarias pulmonares y nutricionales12,13.
Las causas funcionales se caracterizan por deteriorar la fisiología de la deglución11. La mayoría de las causas funcionales de DO se relacionan con alteraciones en el control neurológico central de la fase oral y faríngea de la deglución, el reflejo deglutorio, la modulación del peristaltismo o coordinación neuromuscular del esfínter esofágico superior, o en la acción y sincronización de los efectores musculares involucrados en ella14. En otros términos, existe un trastorno en el funcionamiento orofaríngeo, que lleva a tres grandes alteraciones: a) mala propulsión del bolo; b) mala reconfiguración orofaríngea durante la deglución; y c) mala apertura del esfínter esofágico superior15. Los trastornos neurológicos explican el 70 % a 80 % de la etiología de la DO16. A partir de lo anterior surge la categoría y término de disfagia orofaríngea neurogénica (DON), habitualmente producida por accidente cerebrovascular (ACV), esclerosis lateral amiotrófica (ELA), enfermedad de Parkinson (EP) y miastenia gravis (MG)3.
En pacientes con entidades neurológicas y neurodegenerativas la frecuencia de DON se reporta entre un 30 % al 82 %15,17, y como síndrome geriátrico afecta del 56 % al 78 % de los adultos mayores institucionalizados y al 44 % de adultos mayores ingresados a un hospital general18. Entre 400.000 a 800.000 personas en el mundo desarrollan DON al año19.
La disfagia en general produce un amplio espectro de síntomas y signos que se usan en los métodos de tamizaje, en las evaluaciones formales de tipo clínico y en las pruebas instrumentales, para detectar la presencia y gravedad de esta. La evaluación formal clínica estándar es el examen clínico de la deglución (ECD) a la cabecera del paciente (bedside swallow examination), que consiste en un proceso basado en historia clínica y ejecución de un examen físico exhaustivo de la anatomía oral, faríngea, laríngea más aspectos neurológicos centrados en función sensorial, motora, cognitiva, conductual y del lenguaje20,21; algunos autores la definen como una lista de chequeo clínico ejecutada principalmente por fonoaudiólogos entrenados en deglución20.
Se han publicado modelos predictivos en deglución aplicados en disfagia aguda luego de radioterapia en pacientes con cáncer de cabeza y cuello22, disfagia persistente en ACV23, riesgo de aspiración24 y recuperación de disfagia post ACV25. Sin embargo, se carece de modelos de regresión logística y flujogramas basados en el comportamiento conjunto de síntomas y signos para detectar o clasificar pacientes con DON, el cual podría ser un complemento a la ECD y pruebas de referencia como la video fluoroscopia de la deglución (VFSS) y la evaluación endoscópica funcional de la deglución (FEES).
El objetivo de este estudio fue desarrollar un modelo (algoritmo) explicativo basado en características clínicas del ECD y prueba oro motor con diferentes consistencias/volumen, para diferenciar personas sanas de pacientes con DON de causas neurológicas y neuromusculares.
Materiales y Métodos
Estudio de casos y controles basado en un conjunto de datos que están almacenados en el Data-Set MedSwallowDB: base de datos clínica derivada del ECD con énfasis neurológico realizado en pacientes con DON de causas neurológicas y neuromusculares (casos), y en personas sanas (controles)26.
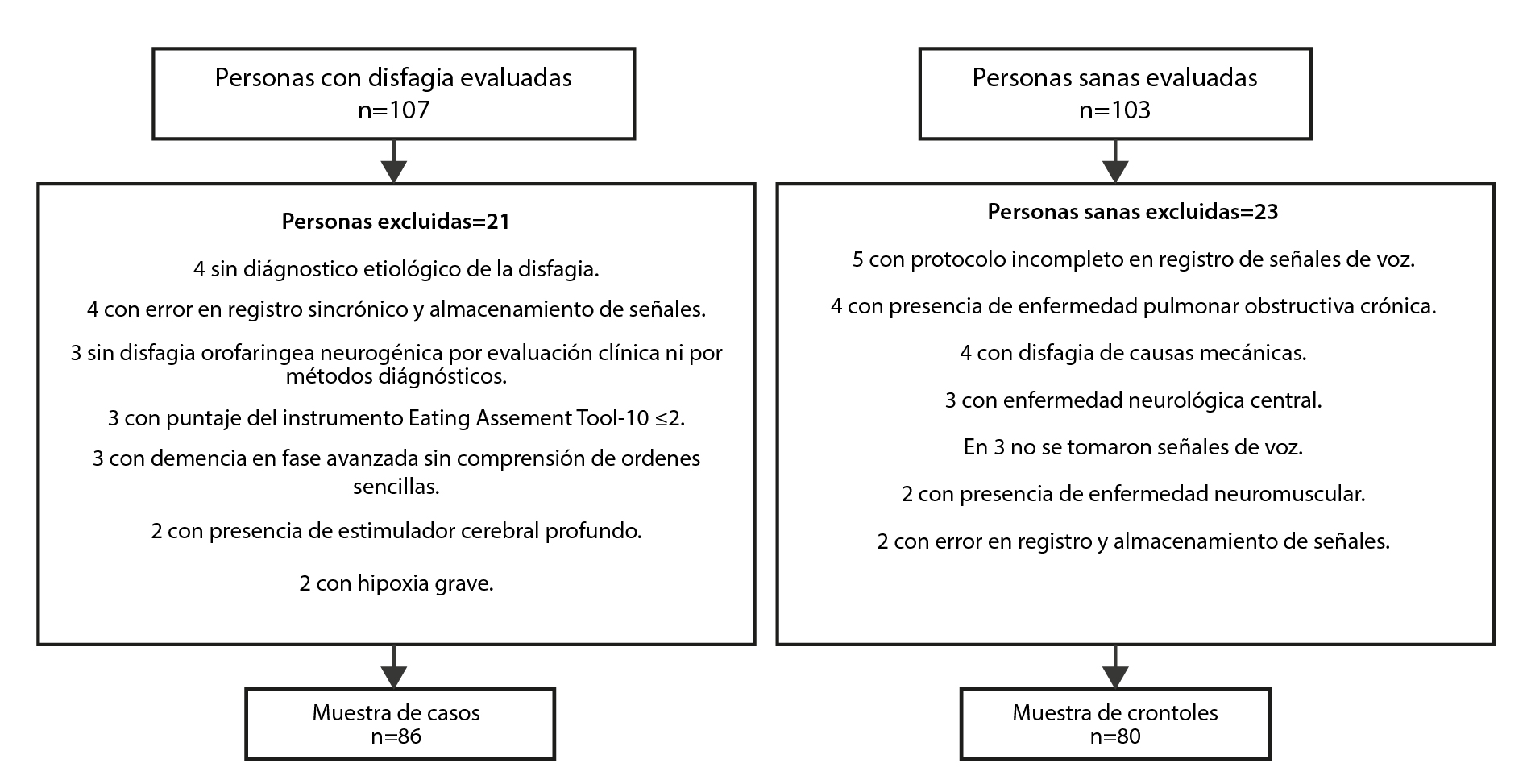
Se reportó previamente un tamaño de muestra para identificar las variables clínicas que junto a la integración de señales no invasivas (electromiografía de superficie y acelerometría laríngea), permitirían mejorar la sensibilidad en la diferenciación de pacientes con DON de causas neurológicas y neuromusculares de pacientes sanos27. En breve, se suponía una sensibilidad del ECD del 80%7, un incremento del 15% de la sensibilidad, una potencia del 80% y una confianza del 95%. Se logró captar 210 personas (107 pacientes y 103 sanos), para seleccionar (según criterios) a 166 personas (86 casos y 80 controles), que fueron analizados todos para dar respuesta a la pregunta: ¿Qué características clínicas del ECD y prueba oro motor con diferentes consistencias/volumen al ser integradas en un modelo logran diferenciar sanos de pacientes con DON de causas neurológicas y neuromusculares?
Criterios de elegibilidad para casos: edad ≥18 años, ambos sexos; presencia de DON de al menos un mes o más de evolución. Diagnóstico de patologías neurológicas centrales o neuromusculares que en su evolución han originado DO. Puntaje total en el instrumento Eating Assessment Tool (EAT-10) ≥3 puntos. Síntoma de tos, de comida pegada en la garganta o sensación de atragantamiento en relación con tragar alimentos o cambios de la voz al tragar, dificultades para iniciar la deglución o necesidad de múltiples degluciones para tragar alimentos visualizados al examen físico. Fueron excluidos pacientes con disfagia esofágica, disfagia mecánica, de propulsión o iatrogénica; piel de región facial y/o cervical irradiada; edema o hematomas orofaciales o cervicales; disección quirúrgica reciente (<3 meses) en piel de cuello; hipoxemia grave (saturación de oxígeno ambiente <80 %, que no responde a oxigenoterapia); demencia en fase avanzada que impida comprensión de órdenes sencillas para masticar y tragar; presentar malformaciones estructurales congénitas en cavidad oral, lengua o cuello; tener diagnóstico de enfermedad de Sjögren y estar en procedimientos activos por endodoncia.
Criterios de elegibilidad para controles: edad ≥18 años, ambos sexos; sin diagnóstico de disfagia, patologías neurológicas centrales, periféricas ni neuromusculares. Puntaje total en EAT-10 <3 puntos. Ausencia de comorbilidades tipo cáncer de cabeza y cuello, enfermedad pulmonar obstructiva crónica (EPOC), y de procedimientos quirúrgicos en las 2/3 partes inferiores del rostro o cuello, ni utilización de toxina botulínica en cabeza/cuello. Se excluyeron sanos en procedimientos activos por endodoncia; con presencia de malformaciones congénitas en cavidad oral, lengua y cuello; diagnóstico de enfermedad de Sjögren y compromiso cognitivo.
Los pacientes fueron captados en doce consultorios particulares de profesionales en fonoaudiología y deglución, diez instituciones prestadoras de salud (IPS) con servicios en disfagia, cuatro IPS de adultos mayores y tres fundaciones de pacientes ubicadas en el valle de Aburrá y de San Nicolás en el departamento de Antioquia, Colombia.
Los sanos fueron captados en dos centros de socialización y ocio para adultos mayores, dos instituciones universitarias, una junta de acción comunal ubicadas en el valle de Aburrá (Medellín) y de familiares sanos de los pacientes.
La validación de los criterios de elegibilidad para la selección del grupo casos fue realizada por una médica neuróloga con experiencia asistencial en DON, con apoyo de fonoaudióloga entrenada en deglución/disfagia. La validación de criterios para la selección de controles fue realizada por médico especialista entrenado en deglución/disfagia. La captación, selección y obtención de variables en ambos grupos fueron realizadas entre el primer semestre de 2019 al segundo semestre de 2022, de manera que la selección de los controles fue simultánea a la captación y selección de los casos.
En ambos grupos se diligenció el instrumento EAT-10 con validación para Colombia2, se aplicó el mismo protocolo para realizar el ECD con el propósito de obtener datos comparables, y los grupos (casos/controles) fueron pareados por edad.
El ECD incluyó anamnesis centrada en antecedentes médicos, características de la deglución y síntomas de disfagia, más evaluación de la anatomía, funcionamiento, sensibilidad y reflejos del aparato deglutorio (centrado en fase oral y faríngea) mediante examen físico de cavidad oral, sistema respiratorio, de pares craneanos bajos más olfatorio, trigémino y facial, ejecución de praxias orofaciales y auscultación pulmonar. Se preguntó por consumo de medicamentos que puedan modifican la deglución (e.g neurolépticos, barbitúricos, ansiolíticos, antiinflamatorios no esteroideos, relajantes musculares, anticolinérgicos y antidepresivos tricíclicos). Se incluyó toma de talla/peso y saturación de oxígeno, y se realizó test oro motor utilizando alimentos terapéuticos con diferentes consistencias/volúmenes (vía oral).
La prueba oro motor incluyó tragar 5, 10 y 20 ml de yogur espeso sin trozos de frutas, tres gramos de galleta seca y salada, y 5, 10 y 20 ml de agua. Entre cada consistencia se solicitó a la persona tomar un trago de saliva. En ambos grupos se evaluó la preparación del bolo, adosamiento, competencia labial, capacidad para manejar secreciones, presencia o no de fatigabilidad, carraspeo, residuos orales y tos, elevación laríngea, necesidad o no de múltiples degluciones, presencia de regurgitación nasal y cualificación del reflejo de deglución.
Las variables obtenidas se agruparon en antecedentes, características de la deglución, síntomas de disfagia, signos al examen físico y hallazgos clínicos a la prueba oro motor. El puntaje final del EAT-10 se consideró como una variable cuantitativa en el grupo de síntomas. Las variables cuantitativas de saturación de oxígeno, peso, talla e índice de masa corporal (IMC) hacen parte del conjunto de signos al examen físico.
Se utilizó estadística descriptiva en el conjunto de variables evaluando previamente normalidad mediante la prueba de Shapiro-Wilk, y análisis transversal para comparar el conjunto de variables e identificar aquellas con diferencias estadísticamente significativas, mediante la realización de comparaciones y construcción de tablas de contingencia entre casos/controles, y así obtener odds ratio (OR) exploratorios acompañados de intervalos de confianza del 95 %. La prueba de significación (valor p) en las variables cualitativas se obtuvo mediante Chi cuadrado o test exacto de Fisher, identificando aquellas variables con diferencias estadísticamente muy significativas (valor p <0,005) como método de reducción de variables.
En las variables cuantitativas fue realizada prueba de significancia mediante U de Mann-Whitney (en variables con distribución no normal) y T de Student o T de Welch (en variables con distribución normal y test de homogeneidad de Levene). Luego se identificaron aquellas variables con valor p <0,005.
Una vez se identificaron las variables clínicas con diferencias estadísticas muy significativas, se procedió a construir varios modelos de regresión logística binaria (RLB), modelos explicativos y no predictivos.
Parámetros para la construcción de los modelos de RLB: a) variable dependiente fue la categoría de ser sano o paciente (nivel de referencia: sano); b) las covariables fueron las variables clínicas previamente identificadas; c) evaluación de colinealidad mediante el factor de inflación de varianza (VIF) con valores ideales entre 1 y 3; d) criterio de información de Akaike (AIC) como medida de ajuste del modelo; e) explicación del modelo a través de R2 de Nagelkerke (R2N); f) OR e intervalos de confianza del 95 %; y g) el supuesto de independencia de las observaciones se garantizó por el diseño del estudio, donde los controles procedieron de lugares diferentes a los casos.
Todo el procesamiento se realizó en el programa estadístico libre Jamovi versión 2.2.5.0. Se cuenta con el consentimiento informado de todas las personas estudiadas. Estudio aprobado por Comité de Ética de Investigación en Salud de la Universidad Pontificia Bolivariana (acta N.º 7, junio 1 de 2017), comité de ética de investigación Fundación Hospitalaria San Vicente Paúl (acta N.º 35-2018, diciembre 21 de 2018) y comité de ética en investigación de la Clínica Somer (acta N°01-2019, febrero 8 de 2019).
Resultados
Entre marzo del año 2019 hasta diciembre de 2021 fueron evaluadas 210 personas, 107 (51 %) pacientes con DO y 103 (49 %) sanas. Muestra final de 166 personas: 86 casos con DON por causas neurológicas y neuromusculares, y 80 controles (ver Figura 1). Ambos grupos con igual protocolo de evaluación.
El sexo masculino fue más frecuente en los casos con un 59,30 % (51/86) y en controles fue el sexo femenino con un 53,75 % (43/80), sin diferencias estadísticamente significativas (p=0,092). La mediana de edad en ambos grupos fue cercana a los 61 años (rango intercuartílico: 51:67), sin diferencias estadísticamente significativas (p=0,798). Ambos grupos similares en cuanto a sexo y edad. En la Tabla 1 se detallan las características sociodemográficas y de antecedentes en ambos grupos.
Tabla 1. Características sociodemográficas y antecedentes de la población de estudio
X
Tabla 1. Características sociodemográficas y antecedentes de la población de estudio
| Variables |
Casos (86) |
Controles (80) |
| Edad (años). Mediana (RIC) |
60,5 (48,3:68) |
61,5 (54:66,3) |
| Sexo %(n) |
|
|
| Femenino |
40,70 (35) |
53,75 (43) |
| Masculino |
59,30 (51) |
46,25 (37) |
| Comorbilidades %(n) |
|
|
| Cardiovascular |
40,70 (35) |
30,00 (24) |
| Tiroidea |
10,47 (9) |
13,75 (11) |
| Dislipidemia |
10,47 (9) |
13,75 (11) |
| Gastrointestinal |
9,30 (8) |
12,50 (10) |
| Reumatológica |
10,47 (9) |
10,00 (8) |
| Diabética |
12,79 (11) |
6,25 (5) |
| Neurológica |
19,77 (17) |
3,75 (3) |
| Respiratoria |
18,60 (16) |
3,75 (3) |
| Emocional |
6,98 (6) |
3,75 (3) |
| Presencia de deficiencias %(n) |
|
|
| Múltiple |
43,02 (37) |
0 (0) |
| Física |
39,53 (34) |
0 (0) |
| Intelectual |
4,65 (4) |
0 (0) |
| Ninguna |
12,79 (11) |
100 (80) |
| Recepción de terapias %(n) |
|
|
| Terapia física |
38,37 (33) |
0 (0) |
| Terapia de la deglución |
34,88 (30) |
0 (0) |
| Terapia respiratoria |
5,81 (5) |
0 (0) |
| Antecedentes respiratorios %(n) |
|
|
| Intubación mayor a una semana |
13,95 (12) |
2,50 (2) |
| Traqueostomía mayor a seis meses |
8,14 (7) |
0 (0) |
| Neumonía recurrente |
4,65 (4) |
0 (0) |
| Neumonía por aspiración |
12,79 (11) |
0 (0) |
RIC: rango inter-cuartil.
En los casos, la etiología de la DON fue por causas neurológicas centrales en el 88,37 % (76/86) y por causas neuromusculares en el 11,62 % (10/86), y la mediana del tiempo de evolución de la DON fue de 1,3 años (rango intercuartílico: 0,6:3).
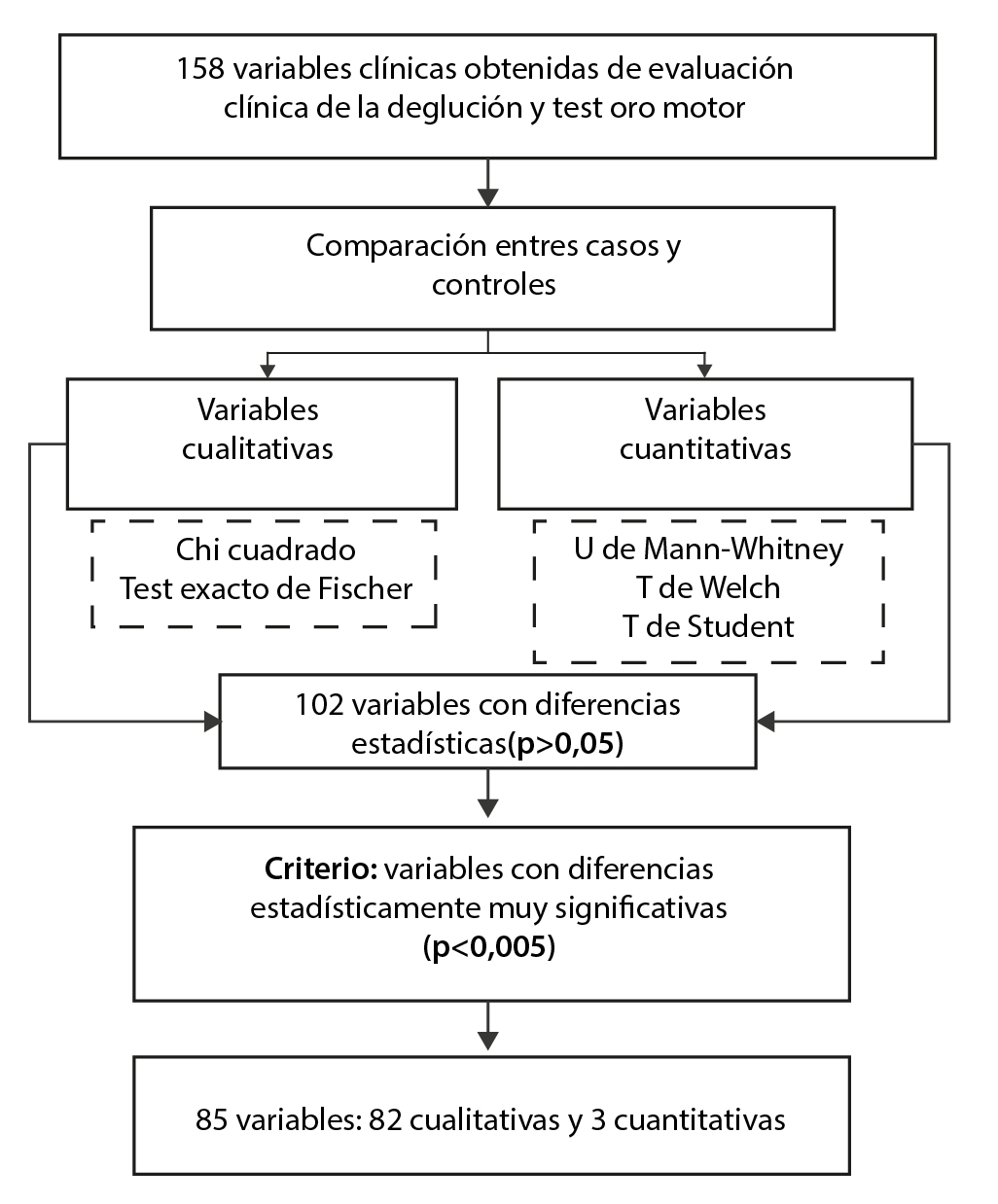
En ambos grupos se obtuvo un conjunto de 158 variables clínicas, agrupadas en 25 antecedentes, 38 características de la deglución y síntomas de disfagia, 48 signos al examen físico, y 47 hallazgos clínicos de la prueba oro motor con consistencias/volúmenes.
Del conjunto de variables obtenidas del ECD el 64,55 % (102/158) con diferencias estadísticamente significativas (p<0,05) entre casos y controles, de las cuales el 80,39 % (82/102) presentaron diferencias estadísticamente muy significativas (p<0,005), y conformaron el conjunto de variables clínicas a ingresar para la construcción del modelo de RLB. En la Tabla 2 se detallan las 82 variables cualitativas, agrupadas por antecedentes, características de la deglución, síntomas, signos y hallazgos a la prueba oro motor, con diferencias estadísticas muy significativas acompañadas de valor p y OR.
Tabla 2. Variables cualitativas del examen clínico de la deglución con diferencias estadísticas muy significativas (p<0,005) entre casos y controles
X
Tabla 2. Variables cualitativas del examen clínico de la deglución con diferencias estadísticas muy significativas (p<0,005) entre casos y controles
| Variables |
Casos %(n) (86) |
Controles %(n) (80) |
Valor-p |
OR (IC 95%) |
| Antecedentes |
|
|
|
|
| Comorbilidad neurológica § |
19,77 (17) |
3,75 (3) |
0,002 |
6,32 (1,78 - 22,50) |
| Comorbilidad respiratoria^ |
18,60 (16) |
3,75 (3) |
0,003 |
5,87 (1,64 - 21) |
| Deficiencia permanente múltiple |
43,02 (37) |
0 (0) |
<0,001 |
122 (7,32 - 2031) |
| Deficiencia permanente física |
39,53 (34) |
0 (0) |
<0,001 |
106 (6,35 - 1763) |
| Tomar medicación que pueda modificar deglución |
30,23 (26) |
7,50 (6) |
<0,001 |
5,34 (2,07 - 13,80) |
| Intubación mayor a una semana |
13,95 (12) |
2,50 (2) |
0,008 |
6,32 (1,37 - 29,20) |
| Neumonía por aspiración |
12,79 (11) |
0 (0) |
<0,001 |
24,5 (1,42 - 423) |
| Recepción de terapia física |
38,37 (33) |
0 (0) |
<0,001 |
101 (6,05 - 1681) |
| Recepción de terapia de la deglución |
34,88 (30) |
0 (0) |
<0,001 |
86,90 (5,21 - 1451) |
| Características de la deglución |
|
|
|
|
| No tolerancia oral a líquidos claros |
29,07 (25) |
0 (0) |
<0,001 |
66,80 (3,99 - 1118) |
| No tolerancia oral a sólidos húmedos |
17,44 (15) |
1,25 (1) |
<0,001 |
16,70 (2,15 -130) |
| No tolerancia oral a sólidos secos |
46,51 (40) |
0 (0) |
<0,001 |
140 (8,42 - 2334) |
| No tolerancia oral a sólidos duros |
69,77 (60) |
0 (0) |
<0,001 |
368 (22 - 6152) |
| No tolerancia oral a consistencias mixtas |
31,40 (27) |
0 (0) |
<0,001 |
74,40 (4.45 - 1245) |
| Refiere problemas para iniciar o comenzar a tragar |
32,56 (28) |
0 (0) |
<0,001 |
78,40 (4,69 - 1311) |
| Sensación de comida pegada luego de tragar |
89,53 (77) |
1,25 (1) |
<0,001 |
676 (83,6 - 5463) |
| Síntomas |
|
|
|
|
| Tos antes de tragar |
17,44 (15) |
2,50 (2) |
0,002 |
8,24 (1,82 - 37,30) |
| Tos después de tragar |
73,26 (63) |
0 (0) |
<0,001 |
435 (25,90 - 7301) |
| Sensación de ahogo después de tragar |
46,51 (40) |
2,50 (2) |
<0,001 |
33,90 (7,83 - 147) |
| Pérdida del apetito |
32,56 (28) |
3,75 (3) |
<0,001 |
12,40 (3,59 - 42,80) |
| Temor para comer |
23,26 (20) |
1,25 (1) |
<0,001 |
23,90 (3,13 - 183) |
| Pérdida del gusto |
19,77 (17) |
2,50 (2) |
<0,001 |
9,61 (2,14 - 43,10) |
| Pérdida de peso |
41,86 (36) |
10,00 (8) |
<0,001 |
6,48 (2,78 - 15,10) |
| Sensación de llenura continua |
25,58 (22) |
6,25 (5) |
<0,001 |
5,16 (1,85 - 14,40) |
| Regurgitación nasal de comida |
12,79 (11) |
0 (0) |
<0,001 |
24,50 (1,42 - 423) |
| Dificultad para masticar |
40,70 (35) |
2,50 (2) |
<0,001 |
26,80 (6.17 - 116) |
| Odinofagia |
13,95 (12) |
0 (0) |
<0,001 |
27 (1,57 - 464) |
| Dolor en el tórax |
12,79 (11) |
1,25 (1) |
0,004 |
11,60 (1,46 - 91,90) |
| Signos al examen físico |
|
|
|
|
| Compromiso marcha |
60,47 (52) |
0 (0) |
<0,001 |
245 (14,7 - 4083) |
| Compromiso sensitivo del nervio mandibular (V3) |
18,60 (16) |
0 (0) |
<0,001 |
37,70 (2,22 - 640) |
| Reflejo mandibular alterado |
39,53 (34) |
2,50 (2) |
<0,001 |
25,50 (5,87 - 111) |
| Parálisis facial central |
13,95 (12) |
0 (0) |
<0,001 |
27 (1,57 - 464) |
| Reflejo nauseoso derecho ausente |
20,93 (18) |
51,25 (41) |
<0,001 |
0,25 (0,12 - 0,49) |
| Reflejo nauseoso izquierdo ausente |
18,60 (16) |
52,50 (42) |
<0,001 |
0,20 (0,10 - 0,41) |
| Fuerza lingual alterada |
18,60 (16) |
1,25 (1) |
<0,001 |
18,10 (2,33 - 140) |
| Coordinación lingual alterada |
12,79 (11) |
1,25 (1) |
0,004 |
11,60 (1,46 - 91,90) |
| Presencia de fasciculación lingual |
27,91 (24) |
1,25 (1) |
<0,001 |
30,60 (4,03 - 232) |
| Presencia de atrofia lingual |
11,63 (10) |
0 (0) |
0,002 |
22,10 (1,27 - 384) |
| Presencia de boca seca |
22,09 (19) |
0 (0) |
<0,001 |
46,50 (2.76 - 785) |
| Dificultad en gesto: protruir labios |
18,60 (16) |
1,25 (1) |
<0,001 |
18,10 (2,33 - 140) |
| Dificultad en gesto: sonreír |
16,28 (14) |
0 (0) |
<0,001 |
32,20 (1,89 - 549) |
| Dificultad en gesto: llevar labios juntos a la derecha |
26,74 (23) |
3,75 (3) |
<0,001 |
9,37 (2,69 - 32,70) |
| Dificultad en gesto: llevar labios juntos a la izquierda |
27,91 (24) |
3,75 (3) |
<0,001 |
9,94 (2,86 - 34,50) |
| Dificultad en gesto: llevar labios juntos ambos lados |
29,07 (25) |
5,00 (4) |
<0,001 |
7,9 (2,57 - 23,60) |
| Hallazgos clínicos en la prueba oro motor con consistencias/volumen vía oral |
|
|
|
|
| No logra preparación bolo alimenticio con galleta |
16,28 (14) |
0 (0) |
<0,001 |
32,20 (1,89 - 549) |
| No logra preparación bolo alimenticio con agua |
12,79 (11) |
0 (0) |
<0,001 |
24,50 (1,42 - 423) |
| No adosamiento con saliva |
20,93 (18) |
2,50 (2) |
<0,001 |
10,30 (2,31 - 46,10) |
| No adosamiento con galleta |
33,72 (29) |
7,50 (6) |
<0,001 |
6,27 (2,44 -16,10) |
| No adosamiento con agua |
26,74 (23) |
6,25 (5) |
<0,001 |
5,48 (1,97 - 15,20) |
| No hay competencia labial para saliva |
16,28 (14) |
0 (0) |
<0,001 |
32,20 (1,89 - 549) |
| No hay competencia labial para yogur |
20,93 (18) |
0 (0) |
<0,001 |
43,50 (2,57 - 735) |
| No hay competencia labial para galleta |
24,42 (21) |
0 (0) |
<0,001 |
52,80 (3,14 - 889) |
| No hay competencia labial para agua |
27,91 (24) |
1,25 (1) |
<0,001 |
30,60 (4,03 - 232) |
| No capacidad para manejar secreciones con saliva |
53,49 (46) |
0 (0) |
<0,001 |
185 (11,10 - 3077) |
| No capacidad para manejar secreciones con yogur |
52,33 (45) |
1,25 (1) |
<0,001 |
86,70 (11,50 - 652) |
| No capacidad para manejar secreciones con galleta |
54,65 (47) |
0 (0) |
<0,001 |
194 (11,60 - 3223) |
| No capacidad para manejar secreciones con agua |
55,81 (48) |
0 (0) |
<0,001 |
302 (12,20 - 3377) |
| Presencia de fatigabilidad con saliva |
10,47 (9) |
0 (0) |
0,003 |
19,70 (1,13 - 345) |
| Presencia de fatigabilidad con yogur |
12,79 (11) |
0 (0) |
<0,001 |
24,5 (1,42 - 423) |
| Presencia de fatigabilidad con galleta |
10,47 (9) |
0 (0) |
0,003 |
19,70 (1,13 - 345) |
| Presencia de fatigabilidad con agua |
16,28 (14) |
0 (0) |
<0,001 |
32,20 (1,89 - 549) |
| Presencia de carraspeo con saliva |
31,40 (27) |
1,25 (1) |
<0,001 |
36,20 (4,78 - 274) |
| Presencia de carraspeo con yogur |
43,02 (37) |
1,25 (1) |
<0,001 |
59,70 (7,93 - 449) |
| Presencia de carraspeo con galleta |
39,53 (34) |
2,50 (2) |
<0,001 |
25,50 (5,87 - 111) |
| Presencia de carraspeo con agua |
48,84 (42) |
1,25 (1) |
<0,001 |
75,40 (10 - 567) |
| Presencia de residuos orales con saliva |
32,56 (28) |
8,75 (7) |
<0,001 |
5,03 (2,05 - 12,3) |
| Presencia de residuos orales con yogur |
56,98 (49) |
6,25 (5) |
<0,001 |
19,90 (7,30 - 54) |
| Presencia de residuos orales con galleta |
62,79 (54) |
17,50 (14) |
<0,001 |
7,96 (3,86 - 16,40) |
| Presencia de residuos orales con agua |
37,21 (32) |
5,00 (4) |
<0,001 |
11,30 (3,76 - 33,70) |
| Tos con saliva |
17,44 (15) |
0 (0) |
<0,001 |
34,90 (2,05 - 594) |
| Tos con yogur |
17,44 (15) |
1,25 (1) |
<0,001 |
16,70 (2,15 - 130) |
| Tos con galleta |
16,28 (14) |
0 (0) |
<0,001 |
32,20 (1,89 - 549) |
| Tos con agua |
33,72 (29) |
0 (0) |
<0,001 |
82,60 (4,95 - 1380) |
| Elevación laríngea reducida al tragar saliva |
58,14 (50) |
0 (0) |
<0,001 |
223 (13,40 - 3710) |
| Elevación laríngea reducida al tragar yogur |
58,14 (50) |
0 (0) |
<0,001 |
223 (13,40 - 3710) |
| Elevación laríngea reducida al tragar galleta |
53,49 (46) |
0 (0) |
<0,001 |
185 (11,10 - 3077) |
| Elevación laríngea reducida al tragar agua |
59,30 (51) |
0 (0) |
<0,001 |
234 (14 - 3891) |
| Necesidad de múltiples degluciones para saliva |
37,21 (32) |
0 (0) |
<0,001 |
96 (5,76 - 1601) |
| Necesidad de múltiples degluciones para yogur |
79,07 (68) |
10,00 (8) |
<0,001 |
34 (13,90 - 83,30) |
| Necesidad de múltiples degluciones para galleta |
63,95 (55) |
15,00 (12) |
<0,001 |
10,10 (4,72 - 21,40) |
| Necesidad de múltiples degluciones para agua |
73,26 (63) |
6,25 (5) |
<0,001 |
41,10 (14,80 - 114) |
| Reflejo de la deglución alterado |
60,47 (52) |
0 (0) |
<0,001 |
245 (14,70 - 4083) |
§ comorbilidad neurológica: migraña, epilepsia y/o movimientos anormales. ^ comorbilidad respiratoria: enfermedad pulmonar obstructiva crónica, apnea obstructiva del sueño, asma y/o rinitis. Valor p: chi cuadrado y test exacto de Fisher. OR: Odds Ratio. IC: Intervalo de Confianza del 95%.
En la Tabla 3 se muestran las variables cuantitativas del ECD con diferencias estadísticas muy significativas entre ambos grupos.
Tabla 3. Variables cuantitativas del examen clínico de la deglución con diferencias estadísticas muy significativas (p<0,005) entre casos y controles
X
Tabla 3. Variables cuantitativas del examen clínico de la deglución con diferencias estadísticas muy significativas (p<0,005) entre casos y controles
| Variables |
Casos n=86 |
Controles n=80 |
Diferencia |
(IC 95%) |
Valor-p |
| Peso (kg)§ |
Promedio ± DE Shapiro Wilk Valor p |
62,21 ± 14,70 0,89 |
70,52 ± 10,86 0,99 |
-8,31 |
(-12,20; -4,36) |
<0.001a |
| IMC (kg/m2)§ |
Promedio ± DE Shapiro Wilk Valor p |
23,73 ± 4,72 0,01 |
27,5 ± 4,18 0,27 |
-3,87 |
(-5,24; -2,51) |
< 0,001b |
| Puntaje total EAT-10^ |
Mediana (RIC) Shapiro Wilk Valor p |
16 (10,5:21) <0,001 |
0 (0:0) <0,001 |
16 |
(14; 17) |
< 0,001c |
§ distribución normal. ^ distribución no normal. IMC: índice de masa corporal. Kg: kilogramos. m: metros. EAT-10: Eating Assessment Tool. DE: desviación estándar. RIC: rango inter-cuartil. a de Welch. b T de Student. c U de Mann-Whitney. IC: Intervalo de Confianza del 95%.
La Figura 2 muestra en forma resumida el proceso de comparación e identificación por valor p <0,005 de las variables clínicas obtenidas en ambos grupos.
con intervalos de confianza estrechos, que tuvieran sentido semiológico y accesibilidad por parte de profesionales de la salud, para ingresarlas a un modelo de RLB verificando en cada una el VIF con valores entre 1 y 3, y con medida de ajuste por criterio AIC bajo. A partir de lo anterior se logró obtener un modelo de RLB para clasificar sanos de pacientes con DON conformado por nueve variables clínicas: dos de antecedentes respiratorios, dos de síntomas, tres de examen físico y dos de hallazgos en la prueba oro motor con consistencia/volumen (ver Tabla 4).
Tabla 4. Modelo de regresión con variables clínicas para diferenciar sanos de pacientes con disfagia orofaríngea neurogénica por causas neurológicas y neuromusculares
X
Tabla 4. Modelo de regresión con variables clínicas para diferenciar sanos de pacientes con disfagia orofaríngea neurogénica por causas neurológicas y neuromusculares
| Modelo Coeficientes - Categoría Paciente/Sano |
| Predictor |
OR (IC 95%) |
Valor p |
VIF |
| Comorbilidad respiratoria |
19,19 (1,54 - 238,08) |
0,021 |
1,22 |
| Intubación mayor a una semana |
38,48 (4,41 - 335,13) |
<0,001 |
1,20 |
| Síntoma de tos antes de tragar |
19,75 (1,52 - 256,45) |
0,023 |
1,15 |
| Pérdida de apetito actual |
13,69 (2,36 - 79,22) |
0,003 |
1,14 |
| Índice de masa corporal |
0,81 (0,71 - 0,92) |
0,002 |
1,25 |
| Alteración en llevar labios a los lados |
33,54 (5,97 - 188,18) |
< 0,001 |
1,36 |
| Presencia de fasciculaciones linguales |
67,43 (5,87 - 774,81) |
< 0,001 |
1,12 |
| Múltiples degluciones con galleta |
14,37 (3,88 - 53,22) |
< 0,001 |
1,34 |
| Tos con yogur |
62,72 (3,94 - 996,44) |
0,003 |
1,22 |
| Medidas de ajuste del modelo |
| Model |
|
AIC |
R² N |
| Variables clínicas |
|
102 |
0,788 |
OR: odds ratio. IC 95 %: intervalos de confianza del 95 %. VIF: factor de inflación de la varianza. AIC: criterio de información de Akaike. R2N: R cuadrado de Nagelkerke.
Discusión
A partir de un extenso conjunto de variables clínicas obtenidas tanto en casos como en controles, se logró identificar en un primer paso aquellas que individualmente fueran diferentes, y luego en conjunto, identificar las que lograran explicar en buena medida el fenómeno llamado DON. De esta forma se obtuvo un modelo explicativo (primer consenso de variables que podrían alimentar un algoritmo clínico) original y pionero alimentado por nueve variables con la capacidad de explicar el 78,88 % del fenómeno, en este caso, explicar cuando se es paciente con DON de causas neurológicas y neuromusculares versus ser sano sin disfagia.
Las variables del modelo se obtuvieron del ECD y realización de prueba oro motor con consistencia/volumen. Actividades de evaluación clínica habitualmente realizadas por profesionales de fonoaudiología, terapia respiratoria, enfermería y medicina, entrenados en deglución y disfagia, lo que puede permitir el uso potencial de modelos basados en estas características para clasificar pacientes con DO y DON en el ámbito asistencial.
La exploración y obtención de modelos, tanto explicativos como predictivos, en el tema de disfagia se ha realizado en el contexto de pacientes con cáncer de cabeza y cuello, ACV y predicción de disfagia y aspiración, y no tanto en la clasificación o identificación de subtipos de disfagia (e.g. DON). Los modelos publicados utilizan variables clínicas en combinación con otras variables de tratamiento, laboratorio o escalas de funcionalidad. Uno de ellos es el modelo predictivo para disfagia aguda posterior a radioterapia por cáncer de cabeza y cuello, que utiliza variables clínicas (como edad, sexo y ubicación del tumor), parámetros de tratamiento y de dosimetría más polimorfismos genéticos, en el que se reporta un área bajo la curva ROC de 0,7122.
El modelo predictivo de presencia o no de disfagia seis meses luego de un ACV utiliza hallazgos clínicos de VFSS inicial como cierre de labios, formación del bolo, masticación, apraxia, contacto lengua-paladar, tiempo de tránsito oral, residuos en valleculas o seno piriforme, elevación laríngea y aspiración, logrando una sensibilidad de 0,91 y especificidad de 0,9223.
Otro es el modelo predictivo de aspiración en pacientes con DO, que utiliza datos obtenidos del estado de ingesta oral, estado de salud funcional y calidad de vida relacionada con la salud que obtuvo un AUC de 0,9224.
Modelos basados en regresión logística y regresión multi lineal para identificar riesgo y protección de disfagia post ACV indican que el tipo de ACV, puntaje del minimental test, escala de gravedad de sialorrea, nivel de hemoglobina y apnea obstructiva del sueño tienen un valor predictivo significativo para el desenlace25.
El modelo explicativo aquí obtenido muestra que dos antecedentes relacionados con el sistema respiratorio que se suelen obtener por anamnesis (presencia de comorbilidad respiratoria tipo EPOC, apnea obstructiva del sueño, asma o rinitis; e intubación mayor a una semana), dos síntomas relacionados con disfagia (como tos antes de tragar y pérdida actual del apetito), tres signos derivados del examen físico centrado en la deglución (cambios en el índice de masa corporal especialmente en rango infra peso y peso normal , alteración en la praxia orofacial de llevar labios juntos a los lados tras orden verbal o por imitación, y presencia de fasciculaciones linguales) y dos hallazgos (que también son signos) al realizar el test oro motor con consistencias/volumen por vía oral (como la necesidad de múltiples degluciones al intentar tragar consistencia dura y seca como galleta, y tos al tomar consistencia espesa como yogur), al estar presentes en conjunto, explican en un 78,88 % el fenómeno de ser paciente con DON por causas neurológicas y neuromusculares.
Si bien no hay modelos publicados centrados en el comportamiento conjunto de variables clínicas derivadas del ECD para identificar y caracterizar la presencia de DON de causas neurológicas y neuromusculares (como lo es el modelo explicativo obtenido en este estudio), hay reportes sobre variables clínicas individuales y su relación con disfagia en general, DO y el subtipo clínico de DON.
En el contexto de pacientes con DO las infecciones torácicas a repetición, la bronquitis o neumonía se consideran síntomas indirectos de disfagia11, pero las infecciones respiratorias a repetición, enfermedad respiratoria crónica, neumonía, espasmos bronquiales, obstrucción de vía aérea, entre otras situaciones respiratorias, nutricionales y gastrointestinales son complicaciones secundarias, que se presentan con mayor frecuencia en pacientes con DON28. Es por ello por lo que los antecedentes respiratorios, incluyendo la intubación mayor a una semana (como posible indicador de afección respiratoria grave) ingresaron al modelo.
Un síntoma cardinal de disfagia en general es la sensación de adherencia o dificultad en el tránsito de los alimentos a través del aparato digestivo y respiratorio superior4,5, que se relaciona con los síntomas de tos al tragar e hiporexia; pero que al analizarlas en conjunto con variables de antecedentes y signos al examen físico logran explicar la presencia de DON por causas neurológicas y neuromusculares.
Clínicamente, el derrame de comida por los labios, ptialismo, regurgitación nasal, tos, asfixia, comida pegada en garganta, evitar algunas consistencias alimenticias o cambios en la postura son síntomas directos de DO, y la pérdida de peso, bronquitis, neumonía, tiempo para comer prolongado, tos y cambios en la voz, articulación, habla o en el lenguaje son síntomas indirectos11. La regurgitación nasal de alimentos, la necesidad de múltiples degluciones para un bolo pequeño y antecedente de infecciones respiratorias repetitivas orientan a una DON29. Por lo tanto, el modelo obtenido cuenta con el comportamiento en conjunto de síntomas directos e indirectos de DO.
Deficiencias en el movimiento facial voluntario en pacientes con DO puede indicar la presencia de una enfermedad neurológica de carácter progresivo11. Las apraxias orofaciales representan pérdidas del control voluntario en músculos faciales, linguales, faríngeos o masticatorios en presencia de función muscular, refleja, espontánea y automática preservadas30. En la búsqueda realizada solo se encontró un trabajo realizado en 60 pacientes con un primer ACV isquémico con signos de disfagia, en los cuales la apraxia bucofacial se relacionó con la lateralidad de la lesión31.
En el examen físico se encontraron algunos signos con frecuencias similares entre sanos y pacientes con DON, por lo tanto, el hallazgo de un signo al examen físico en sanos no equivale a presencia de disfagia, y en pacientes, la presencia de un signo aislado no tiene tanto significado semiológico, como si lo tiene la presencia de un conjunto de ellos (como se puede visualizar en el modelo obtenido). En el caso de pacientes con DO sea por causas funcionales u otras, se indica que el examen físico realizado en orofaringe usualmente es normal7. Aspecto que contrasta con el variado espectro de signos presentes al examen físico y test oro motor visualizados y reportados en los casos de este estudio.
Se encontró diferencias estadísticamente significativas en el peso e índice de masa corporal (IMC) entre sanos y pacientes con DON. Teniendo presente que estas dos variables no son únicamente afectadas por efecto directo de la disfagia, porque son condiciones multifactoriales. Se reporta que la pérdida subjetiva de peso se considera un síntoma poco específico, pero que apoya la presencia de DO7,32. La pérdida de peso secundaria a una ingesta reducida es una característica clínica sugestiva de disfagia33.
La no tolerancia oral a líquidos claros, sólidos húmedos, secos o duros, y a consistencias mixtas, y especialmente la dificultad para tragar galleta y yogur objetivadas en los casos del estudio, son síntomas y signos que permiten identificar no solo pacientes con disfagia sino específicamente con DON. Se reporta como síntoma importante de DO la dificultad para tragar en especial sólidos (30) y evitar ciertas texturas de los alimentos11,34.
Cerca de dos terceras partes del grupo casos con las etiologías individuales más frecuentes reportadas de DON: EP, ELA, esclerosis múltiple y ACV8,35. La DON es la consecuencia final y común de varias etiologías individuales que terminan afectando la fisiología de la deglución11, por lo tanto, no se realizó comparación ni división entre los pacientes de causas neurológicas versus neuromusculares.
Fisiopatológicamente se reporta que los pacientes con DON experimentan tres fenómenos básicos propios de la alteración: respuesta deglutoria prolongada, cierre laríngeo retardado y débil propulsión del bolo con riesgo de aspiración36. Lo que origina varios síntomas y signos que al ser identificados en conjunto (en este caso mediante un modelo de RLB) puede ayudar a varios profesionales de salud (personal médico, de enfermería y terapéutico) a identificar y clasificar a dichos pacientes en pro de tipificar la disfagia e iniciar manejo y procesos de rehabilitación más específicos.
Son fortalezas del estudio el proceso de captación y selección simultanea de sanos sin disfagia y pacientes con DON (logrando grupos similares en edad y sexo, pero comparables en cuanto a su situación deglutoria), y la aplicación en ambos grupos del mismo protocolo de evaluación que incluyó un gran espectro semiológico centrado en deglución y aspectos neurológicos. Se controló el sesgo de selección e información en ambos grupos, mediante la verificación de varios criterios de elegibilidad y evaluación por profesionales diferentes (ambos especialistas) pero entrenados en deglución y disfagia, que aplicaron los mismos instrumentos, protocolo de ECD y prueba oro motor.
El modelo explicativo obtenido se puede ver afectado por el grado de afección (gravedad) deglutoria, neurológica y neuromuscular de los pacientes seleccionados, porque probablemente por los criterios de elegibilidad aplicados son los pacientes más enfermos o sintomáticos con DON. Se sugiere continuar con estudios que incluyan pacientes con DO y DON leve, para visualizar si las variables obtenidas u otras que no ingresaron al modelo logran en conjunto explicar el fenómeno y clasificar de forma similar o superior a los resultados obtenidos, más estudios de modelos predictivos.
Conclusión
La DON hace parte del espectro anatómico y clínico de la disfagia, y como entidad clínica genera una serie de características que pueden ser integradas en modelos explicativos utilizando RLB.
Varias características obtenidas de metodologías de evaluación no invasiva, centradas en la evaluación clínica de la deglución y pruebas oro motoras pueden ser integradas en flujogramas o algoritmos de conjuntos de variables, potencialmente útiles en el ambiente asistencial, incluyendo áreas de bajos recursos o niveles de atención básica e intermedia en salud donde no hay acceso a pruebas instrumentales.
El modelo explicativo obtenido, alimentado por nueve variables clínicas, posibilita ampliar el espectro evaluativo que se realiza en pacientes con sospecha de DON, en pro de clasificar personas sanas de pacientes con DON, caracterizar la etiología (causas neurológicas y neuromusculares) y proponer manejo específico a partir de su reconocimiento, que potencialmente se logra mediante la integración en conjunto de ciertas características obtenidas individualmente al examen físico.
Conflicto de Interés Los autores no poseen ningún conflicto de interés.
Financiación:Trabajo derivado de la investigación “Diagnóstico y seguimiento de pacientes con disfagia neuromuscular y neurogénica mediante la integración de señales no invasivas y variables clínicas” financiada por el Ministerio de Ciencia, Tecnología e Innovación de Colombia - Minciencias (Código 121077758144 y número de contrato 825-2017).
Referencias
X
Referencias
Warnecke T, Labeit B, Schroeder J, Reckels A, Ahring S, Lapa S, et al. Neurogenic Dysphagia: Systematic Review and Proposal of a Classification System. Neurology. 2021;96(6):e876-e889. https://dx.doi.org/10.1212/WNL.0000000000011350
X
Referencias
Giraldo-Cadavid LF, Gutiérrez-Achury AM, Ruales-Suárez K, Rengifo-Varona ML, Barros C, Posada A, et al. Validation of the Spanish Version of the Eating Assessment Tool-10 (EAT-10spa) in Colombia. A Blinded Prospective Cohort Study. Dysphagia.2016;31(3):398-406. https://dx.doi.org/10.1007/s00455-016-9690-1
X
Referencias
Suárez-Escudero JC, Lema Porto KS, Palacio Patiño D, Izquierdo Moreno M, Bedoya Londoño CL. Disfagia orofaríngea neurogénica: concepto, fisiopatología, clínica y terapéutica. Arch Neuroci. 2022;27(4):44-56. https://dx.doi.org/10.31157/an.v27i4.347
X
Referencias
López-Liria R, Fernández-Alonso M, Vega-Ramírez FA, Salido-Campos MÁ, Padilla-Góngora D. Treatment and rehabilitation of dysphagia following cerebrovascular disease. Rev Neurol. 2014;58(6):259–67. https://dx.doi.org/10.33588/rn.5806.2013335
X
Referencias
Altman KW, Yu GP, Schaefer SD. Consequence of dysphagia in the hospitalized patient: impact on prognosis and hospital resources. Arch Otolaryngol Head Neck Surg. 2010;136(8):784-9.https://dx.doi.org/10.1001/archoto.2010.129
X
Referencias
Otolaryngol Clin North Am. Altman KW, Richards A, Goldberg L, Frucht S, McCabe DJ. Dysphagia in stroke, neurodegenerative disease, and advanced dementia. Otolaryngol Clin North Am. 2013;46(6):1137-49. https://dx.doi.org/10.1016/j.otc.2013.08.005
X
Referencias
Duncan S, Gaughey JM, Fallis R, McAuley DF, Walshe M, Blackwood B. Interventions for oropharyngeal dysphagia in acute and critical care: a protocol for a systematic review and meta-analysis. Syst Rev. 2019;8(1):283.https://dx.doi.org/10.1186/s13643-019-1196-0
X
Referencias
Aydogdu I, Kiylioglu N, Tarlaci S, Tanriverdi Z, Alpaydin S, Acarer A, et al. Diagnostic value of “dysphagia limit” for neurogenic dysphagia: 17 years of experience in 1278 adults. Clin Neurophysiol. 2015;126(3):634-43. https://dx.doi.org/10.1016/j.clinph.2014.06.035
X
Referencias
Terré R, Orient-López F, Guevara-Espinosa D, Ramón-Rona S, Bernabeu M, Clavé-Civit P. Disfagia orofaríngea en pacientes afectados de esclerosis múltiple. Rev Neurol. 2004;39(8):707–10. https://dx.doi.org/10.33588/rn.3908.2004247
X
Referencias
De Ruyck K, Duprez F, Werbrouck J, Sabbe N, Sofie DL, Boterberg T, et al. A predictive model for dysphagia following IMRT for head and neck cancer: introduction of the EMLasso technique. Radiother Oncol. 2013;107(3):295-9. https://dx.doi.org/10.1016/j.radonc.2013.03.021
X
Referencias
Heijnen BJ, Böhringer S, Speyer R. Prediction of aspiration in dysphagia using logistic regression: oral intake and self-evaluation. Eur Arch Otorhinolaryngol. 2020;277(1):197-205. https://dx.doi.org/10.1007/s00405-019-05687-z
X
Referencias
Xi X, Li H, Wang L, Yin X, Zeng J, Song Y, et al. How demographic and clinical characteristics contribute to the recovery of post-stroke dysphagia? Medicine (Baltimore). 2021;100(4):e24477. https://dx.doi.org/10.1097/MD.0000000000024477
X
Referencias
Suárez-Escudero JC, Martínez-Moreno L, Gómez-Ríos E, Rueda-Vallejo ZV. Percepción temporal de síntomas de disfagia en una cohorte de pacientes con disfagia orofaríngea neurogénica. Salud UIS. 2023;55:e23041. https://doi.org/10.18273/saluduis.55.e:23041
X
Referencias
Oliveira DL, Moreira E a. M, de Freitas MB, Gonçalves J de A, Furkim AM, Clavé P. Pharyngeal Residue and Aspiration and the Relationship with Clinical/Nutritional Status of Patients with Oropharyngeal Dysphagia Submitted to Videofluoroscopy. J Nutr Health Aging. 2017;21(3):336-341.https://dx.doi.org/10.1007/s12603-016-0754-6
X
Referencias
Verin E, Maltete D, Ouahchi Y, Marie JP, Hannequin D, Massardier EG, et al. Submental sensitive transcutaneous electrical stimulation (SSTES) at home in neurogenic oropharyngeal dysphagia: A pilot study. Ann Phys Rehabil Med. 2011;54(6):366-75. https://dx.doi.org/10.1016/j.rehab.2011.07.003
-
Warnecke T, Labeit B, Schroeder J, Reckels A, Ahring S, Lapa S, et al. Neurogenic Dysphagia: Systematic Review and Proposal of a Classification System. Neurology. 2021;96(6):e876-e889. https://dx.doi.org/10.1212/WNL.0000000000011350
-
Giraldo-Cadavid LF, Gutiérrez-Achury AM, Ruales-Suárez K, Rengifo-Varona ML, Barros C, Posada A, et al. Validation of the Spanish Version of the Eating Assessment Tool-10 (EAT-10spa) in Colombia. A Blinded Prospective Cohort Study. Dysphagia.2016;31(3):398-406. https://dx.doi.org/10.1007/s00455-016-9690-1
-
Suárez-Escudero JC, Lema Porto KS, Palacio Patiño D, Izquierdo Moreno M, Bedoya Londoño CL. Disfagia orofaríngea neurogénica: concepto, fisiopatología, clínica y terapéutica. Arch Neuroci. 2022;27(4):44-56. https://dx.doi.org/10.31157/an.v27i4.347
-
López-Liria R, Fernández-Alonso M, Vega-Ramírez FA, Salido-Campos MÁ, Padilla-Góngora D. Treatment and rehabilitation of dysphagia following cerebrovascular disease. Rev Neurol. 2014;58(6):259–67. https://dx.doi.org/10.33588/rn.5806.2013335
-
Zambran-Toledo N. Maintenance of logopedic orientation in a patient with oropharyngeal dysphagia of neurogenic origin. Rev Neurol. 2001;32(10):986–9. https://dx.doi.org/10.33588/rn.3210.2000184
-
Altman KW, Yu GP, Schaefer SD. Consequence of dysphagia in the hospitalized patient: impact on prognosis and hospital resources. Arch Otolaryngol Head Neck Surg. 2010;136(8):784-9.https://dx.doi.org/10.1001/archoto.2010.129
-
Cook IJ. Diagnostic evaluation of dysphagia. Nat Clin Pract Gastroenterol Hepatol. 2008;5(7):393-403. https://dx.doi.org/10.1038/ncpgasthep1153
-
Otolaryngol Clin North Am. Altman KW, Richards A, Goldberg L, Frucht S, McCabe DJ. Dysphagia in stroke, neurodegenerative disease, and advanced dementia. Otolaryngol Clin North Am. 2013;46(6):1137-49. https://dx.doi.org/10.1016/j.otc.2013.08.005
-
Ney DM, Weiss JM, Kind AJH, Robbins J. Senescent swallowing: impact, strategies, and interventions. Nutr Clin Pract. 2009;24(3):395-413. https://dx.doi.org/10.1177/0884533609332005
-
Clavé P, Terré R, de Kraa M, Serra M. Approaching oropharyngeal dysphagia. Rev Esp Enferm Dig. 2004;96(2):119-31.https://dx.doi.org/10.4321/s1130-01082004000200005
-
Rommel N, Hamdy S. Oropharyngeal dysphagia: manifestations and diagnosis. Nat Rev Gastroenterol Hepatol. 2016;13(1):49-59. https://dx.doi.org/10.1038/nrgastro.2015.199
-
Duncan S, Gaughey JM, Fallis R, McAuley DF, Walshe M, Blackwood B. Interventions for oropharyngeal dysphagia in acute and critical care: a protocol for a systematic review and meta-analysis. Syst Rev. 2019;8(1):283.https://dx.doi.org/10.1186/s13643-019-1196-0
-
Gallegos C, Brito-de la Fuente E, Clavé P, Costa A, Assegehegn G. Nutritional Aspects of Dysphagia Management. Adv Food Nutr Res. 2017:81:271-318. https://dx.doi.org/10.1016/bs.afnr.2016.11.008
-
Daniels SK, Foundas AL, Iglesia GC, Sullivan MA. Lesion site in unilateral stroke patients with dysphagia. J Stroke Cerebrovasc Dis. 1996;6(1):30-4. https://dx.doi.org/10.1016/s1052-3057(96)80023-1
-
Cook IJ, Kahrilas PJ. AGA technical review on management of oropharyngeal dysphagia. Gastroenterology. 1999;116(2):455-78. https://dx.doi.org/10.1016/s0016-5085(99)70144-7
-
Aydogdu I, Kiylioglu N, Tarlaci S, Tanriverdi Z, Alpaydin S, Acarer A, et al. Diagnostic value of “dysphagia limit” for neurogenic dysphagia: 17 years of experience in 1278 adults. Clin Neurophysiol. 2015;126(3):634-43. https://dx.doi.org/10.1016/j.clinph.2014.06.035
-
Terré R, Orient-López F, Guevara-Espinosa D, Ramón-Rona S, Bernabeu M, Clavé-Civit P. Disfagia orofaríngea en pacientes afectados de esclerosis múltiple. Rev Neurol. 2004;39(8):707–10. https://dx.doi.org/10.33588/rn.3908.2004247
-
Clavé P, Verdaguer A, Arreola V. Oral-pharyngeal dysphagia in the elderly. Med Clin (Barc). 2005;124(19):742-8. https://dx.doi.org/10.1157/13075447
-
Panebianco M, Marchese-Ragona R, Masiero S, Restivo DA. Dysphagia in neurological diseases: a literature review. Neurol Sci. 2020;41(11):3067-3073. https://dx.doi.org/10.1007/s10072-020-04495-2
-
Carnaby-Mann G, Lenius K. The bedside examination in dysphagia. Phys Med Rehabil Clin N Am. 2008;19(4):747-68. https://dx.doi.org/10.1016/j.pmr.2008.05.008
-
González-Fernández M, Ottenstein L, Atanelov L, Christian AB. Dysphagia after Stroke: an Overview. Curr Phys Med Rehabil Rep. 2013;1(3):187-196. https://dx.doi.org/10.1007/s40141-013-0017-y
-
De Ruyck K, Duprez F, Werbrouck J, Sabbe N, Sofie DL, Boterberg T, et al. A predictive model for dysphagia following IMRT for head and neck cancer: introduction of the EMLasso technique. Radiother Oncol. 2013;107(3):295-9. https://dx.doi.org/10.1016/j.radonc.2013.03.021
-
Han TR, Paik NJ, Park JW, Kwon BS. The prediction of persistent dysphagia beyond six months after stroke. Dysphagia. 2008;23(1):59-64. https://dx.doi.org/10.1007/s00455-007-9097-0
-
Heijnen BJ, Böhringer S, Speyer R. Prediction of aspiration in dysphagia using logistic regression: oral intake and self-evaluation. Eur Arch Otorhinolaryngol. 2020;277(1):197-205. https://dx.doi.org/10.1007/s00405-019-05687-z
-
Xi X, Li H, Wang L, Yin X, Zeng J, Song Y, et al. How demographic and clinical characteristics contribute to the recovery of post-stroke dysphagia? Medicine (Baltimore). 2021;100(4):e24477. https://dx.doi.org/10.1097/MD.0000000000024477
-
Suárez Escudero JC, González Frnaco S, Franco Sánchez I, Gómez Ríos E, Martínez Moreno L. Base de datos clínica casos controles DON. MedSwallowDB: Gitlab 2024. https://gitlab.com/sroldanvasco/medswallowdb/-/blob/main/Base_datos_clinica_casos_controles_DON.xlsx?ref_type=heads
-
Suárez-Escudero JC, Martínez-Moreno L, Gómez-Ríos E, Rueda-Vallejo ZV. Percepción temporal de síntomas de disfagia en una cohorte de pacientes con disfagia orofaríngea neurogénica. Salud UIS. 2023;55:e23041. https://doi.org/10.18273/saluduis.55.e:23041
-
Marik PE. Aspiration pneumonitis and aspiration pneumonia. N Engl J Med. 2001;344(9):665-71. https://dx.doi.org/10.1056/NEJM200103013440908
-
Oliveira DL, Moreira E a. M, de Freitas MB, Gonçalves J de A, Furkim AM, Clavé P. Pharyngeal Residue and Aspiration and the Relationship with Clinical/Nutritional Status of Patients with Oropharyngeal Dysphagia Submitted to Videofluoroscopy. J Nutr Health Aging. 2017;21(3):336-341.https://dx.doi.org/10.1007/s12603-016-0754-6
-
Lobo PP, Pinto S, Rocha L, Reimão S, de Carvalho M. Orofacial apraxia in motor neuron disease. Case Rep Neurol. 2013;5(1):47-51.https://dx.doi.org/10.1159/000349895
-
Steinhagen V, Grossmann A, Benecke R, Walter U. Swallowing disturbance pattern relates to brain lesion location in acute stroke patients. Stroke. 2009;40(5):1903-6. https://dx.doi.org/10.1161/STROKEAHA.108.535468
-
Shaker R. Oropharyngeal Dysphagia. Gastroenterol Hepatol (NY). 2006;2(9):633-634.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5350575/
-
Nazarko L. The management of dysphagia in palliative care. Int J Palliat Nurs. 2017;23(4):162-164. https://dx.doi.org/10.12968/ijpn.2017.23.4.162
-
Leslie P, Carding PN, Wilson JA. Investigation and management of chronic dysphagia. BMJ. 2003;326(7386):433-6.https://dx.doi.org/10.1136/bmj.326.7386.433
-
Verin E, Maltete D, Ouahchi Y, Marie JP, Hannequin D, Massardier EG, et al. Submental sensitive transcutaneous electrical stimulation (SSTES) at home in neurogenic oropharyngeal dysphagia: A pilot study. Ann Phys Rehabil Med. 2011;54(6):366-75. https://dx.doi.org/10.1016/j.rehab.2011.07.003
-
Clavé P, de Kraa M, Arreola V, Girvent M, Farré R, Palomera E, et al. The effect of bolus viscosity on swallowing function in neurogenic dysphagia. Aliment Pharmacol Ther. 2006;24(9):1385-94. https://dx.doi.org/10.1111/j.1365-2036.2006.03118.x